
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОПЫТ № 5. Образование и растворение осадка карбоната кальция (демонстрационный)
ОПЫТ № 4. Влияние величин произведения растворимости на образование осадков
Выполнение:
В две пробирки налейте по 1 см3 раствора нитрата свинца(II) с концентрацией, равной
5 · 10–3 моль/дм3. В одну из пробирок добавьте такой же объём раствора хлорида калия (с = 5 · 10–2 моль/дм3), а в другую – такой же объём раствора иодида калия (с = 5 · 10–2 моль/дм3).
Задания:
Составьте уравнения всех реакций в молекулярной, полной и сокращённой ионно-молекулярных формах. Запишите наблюдаемые явления и объясните их. Рассчитайте величины ПК для хлорида и иодида свинца(II) и сравните их с соответствующими справочными величинами ПР этих веществ. Сделайте вывод о влиянии концентраций ионов малорастворимого электролита на возможность (или невозможность) его выделения из раствора в виде осадка.
Выполнение:
В стаканчике смешайте примерно равные объёмы разбавленных растворов хлорида кальция (с = 1 · 10–2 моль/дм3) и карбоната натрия (с = 1 · 10–2 моль/дм3). Через образовавшуюся взвесь пропустите в течение 1 – 1,5 минут углекислый газ из аппарата Киппа.
Задания:
Напишите уравнения всех реакций в молекулярной, полной и сокращённой ионно-молекулярных формах. Запишите наблюдаемые явления и объясните их. Пользуясь справочными величинами, рассчитайте константу равновесия второй реакции. Примите во внимание, что для процессов, описывающихся общим уравнением MeCO3 + H2CO3 ↔ Me2+ + 2HCO3–, выражение константы равновесия имеет вид:
K равн = 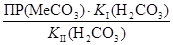 .
.
О чём свидетельствует полученная величина? Сделайте вывод о влиянии значений ПР малорастворимых карбонатов MeCO3 на возможность их растворения в водном растворе оксида углерода(IV).
ОПЫТ № 6. Влияние величин ПР сульфидов на их растворимость в сильной кислоте (проводится в вытяжном шкафу!)
Выполнение:
В первую пробирку налейте 1 см3 раствора сульфата железа(II), во вторую – такой же объем раствора сульфата меди(II). В обе пробирки добавьте по 2 капли раствора сульфида натрия. К образовавшимся осадкам сульфидов прилейте по 2 см3 соляной кислоты (с = 2 моль/дм3).
Задания:
Напишите уравнения всех реакций в молекулярной, полной и сокращённой ионно-молекулярных формах. Запишите наблюдаемые явления и объясните их. Рассчитайте величины констант равновесий FeS + 2H+ ↔ Fe2+ + H2S и СuS + 2H+ ↔ Cu2+ + H2S, учитывая, что для таких процессов константа равновесия имеет вид: K равн = 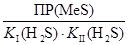 .
.
О чём свидетельствуют полученные величины? Сделайте вывод о влиянии величин ПР малорастворимых сульфидов MeS на возможность их растворения в сильных кислотах.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните задания ко всем опытам. Проведите необходимые расчёты и запишите их в отчёт.
6. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) Охарактеризуйте кислотно-основные свойства гидроксидов магния, цинка, алюминия, никеля(II).
б) В чём проявляется амфотерный характер некоторых гидроксидов? Как его можно объяснить? Приведите примеры других амфотерных гидроксидов.
в) Как можно сместить равновесияе диссоциации слабого электролита? Приведите примеры и объясните суть процессов.
г) Что характеризует величина ПР малорастворимого сильного электролита? От каких факторов зависит её значение?
д) Как по величинам ПР однотипных малорастворимых сильных электролитов можно определить, какой из них наименее растворим?
е) Как можно определить, выпадет ли осадок малорастворимого сильного электролита при смешивании растворов, содержащих образующие его ионы?
ж) Пользуясь справочными данными определите, растворяется ли осадок MnS в соляной кислоте?
=======================================================================
ЛАБОРАТОРНАЯ РАБОТА № 6
«ГИДРОЛИЗ СОЛЕЙ»
Т е о р е т и ч е с к а я ч а с т ь
 |  | ||
На практике для точного определения величин рН растворов различных веществ используют специальные приборы – рН-метры (рис. 1). Примерные значения рН растворов (с точностью ±1) можно определить с помощью универсальной индикаторной бумаги (рис. 2).
|
 |
Её изготавливают, пропитывая фильтровальную бумагу смесью специальных красителей, придающих ей жёлтый цвет. В зависимости от среды растворов универсальная индикаторная бумага окрашивается в определённые цвета. Для определения рН полоску такой бумаги опускают на 1 сек в исследуемый раствор и по цветной шкале определяют искомое значение.
Э к с п е р и м е н т а л ь н а я ч а с т ь
|
|
Дата добавления: 2014-11-25; Просмотров: 1341; Нарушение авторских прав?; Мы поможем в написании вашей работы!