
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація органічних реакцій
|
|
|
|
Конспект лекційного заняття
Основні поняття
Кислотні та основні властивості органічних сполук. Класифікація органічних реакцій і реагентів
ЛЕКЦІЯ №4
Кислотні властивості, основні властивості, реакції приєднання, реакції заміщення, гомолітичні, гетеролітичні реакції.
План лекційного заняття:
1. Кислотні властивості органічних сполук
2. Основні властивості органічних сполук
3. Класифікація органічних реакцій
4. Гемолітичні та гетеролітичні органічні реакції
Література:
1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Высшая школа. – 1979. – 832с.
2. Домбровський А.В., Найдан В.М. Органічнахімія. – К.: Вища школа. – 1992. – 503с.
3. Кери Ф., Сандберг Р. Углубленный курс органической химии: в 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1134с.
4. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии: В 2 книгах. – М.: Химия. – 1981. – Т.1,2. – 1020с.
5. Пальм В.А. Введение в теоретическую органическую химию. – М.:Высшая школа, 1974.
6. Перекалин В.В., Зонис С.А. Органическая химия. – М., 1982.
7. Сайкс П. Механизмы реакций в органической химии. – М.: Хрия, 1973.
8. Самусенко Ю.В., Шиян Н.І. Органічна хімія. – Полтава, 2003.
9. Смолина Т.А., Васильева Н.В., Куплетская Н.Б. Практические работи по органической химии. – М., 1986.
10. Тейлор Г. Основы органической химии для студентов нехимических специальностей: пер. с англ. – М.: Мир. – 1989. – 384с.
Реакції органічних речовин класифікують за напрямком перебігу та за їх механізмами.
Реакції заміщення, або S-реакції – це елементарні або багатостадійні реакції, в яких один атом або група атомів у молекулі заміщуються іншим атомом або групою атомів. Наприклад:

 .
.
Реакції приєднання, або А-реакції такі хімічні реакції, в результаті яких з двох або трьох реагуючих молекул утворюється один продукт реакції. В результаті реакцій приєднання утворюються два нових хімічних зв'язки і зменшується кратність зв'язку в одного з реагентів. Наприклад:
|
|
|
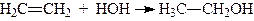
Особливий тип реакцій приєднання становлять реакції полімеризації, наприклад:
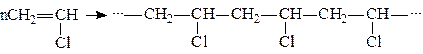
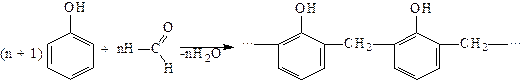
та поліконденсації, наприклад:
Перегрупування – це реакції, у яких відбувається зміна тих частин молекули, яких реагенти безпосередньо не торкаються. Перегрупування супроводяться зміною порядку сполучення атомів у молекулі. Наприклад, ізомеризація 1-бромпропану в 2-бромпропан:
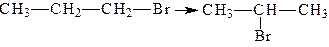
Реакції відщеплення, або Е-реакції – зворотні реакціям приєднання. Наприклад:

У ході цих реакцій відбувається руйнування хімічних зв’язків і утворення нових. Можливі два головних типи розриву ковалентних зв'язків: гомолітичний і гетеролітичний. Розглянемо їх на прикладі ковалентно побудованої органічної сполуки R3C–X, де R можуть бути, наприклад, вуглеводневі радикали або інші різноманітні частини органічної молекули, а Х – атоми Н, Сl, Вr, J, ОН, NO2 або атоми Карбону інших хімічних груп. Реакції розриву супроводжуються в основному поглинанням теплоти і збільшенням об'єму системи, а реакції утворення нових зв’язків – виділенням теплоти і зменшенням об'єму.
4. Гемолітичні та гетеролітичні органічні реакції
Гомолітичні реакції. Гомолітичними називають реакції, які супроводжуються гомолітичним розривом хімічних зв’язків.
При гомолітичному розриві зв'язку С–Х у молекулах R3C–X відбувається “симетричне” роз'єднання пари електронів ковалентного зв'язку так, що один електрон залишається біля атома Карбону, а другий переходить до частинки X:
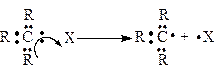
Частинки або атоми (X може бути атом), які утворилися при цьому і мають по одному неспареному електрону, називають вільними радикалами. Отже, радикал – це частина молекули, яка має неспарений електрон, але не має заряду, наприклад, радикал метил Н3С×.
|
|
|
За напрямком перебігу гомолітичними можуть бути реакції заміщення (SR) і реакції приєднання (AR).
Гетеролітичні реакції. Гетеролітичними називають реакції, які супроводжуються гетеролітичним розривом хімічних зв'язків. Гетеролітичний, або іонний, розрив s-зв’язку відбувається “несиметрично”. При цьому в молекулі R3С–Х розрив s-зв’язку С–Х може відбуватися з переходом пари електронів до атома Карбону або до частинки X. Якщо пара електронів перейшла до X, то утворюється карбкатіон R3C+, а якщо до Карбонового атома, то утворюється карбаніон R3C-:
 ;
;
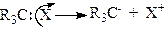 .
.
Карбкатіони є найсильнішими електрофілами. Електрофіли (від лат. Electrophilic – той, що любить електрони), або електрофільні реагенти – це частинки, які мають повний або частковий позитивний заряд (вакантну зв'язуючу орбіталь або дефіцит електронів) і тому є акцепторами електронів. Молекули електрофільних реагентів у процесі реакції можуть також генерувати електрофільні частинки. До електрофільних реагентів крім карбкатіонів R3С+ відносять катіони Н+, Сl+, Вг+, J+, NO2+ та ін. Електрофіли вступають у реакції заміщення і приєднання (SE- і АR-реакції). Наприклад:
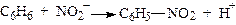 ;
;

Карбаніони – це органічні аніони, які мають парне число електронів або вільну пару електронів на тривалентному атомі Карбону. Карбаніони є одними з найсильніших нуклеофілів. Нуклеофіли (від лат. Nucleophilic – той, що любить ядро), або нуклеофільні реагенти, – аніони або молекули з вільними парами електронів, які мають спорідненість до електрофілів або до позитивно зарядженого центра субстрату і намагаються з ним сполучитися. Нуклеофільними реагентами є основи Льюїса, серед яких крім карбаніопів R3С- найчастіше трапляються аніони Н3СО-, С2H5О-, С6Н5О-, НО-, СN-, NН2-, Н3ССОО-, І-, СІ-, F- та ін., нейтральні молекули з вільними парами електронів.
Нуклеофіли найчастіше вступають у реакції заміщення (SN-реакції). Наприклад:
 .
.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 3267; Нарушение авторских прав?; Мы поможем в написании вашей работы!