
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворение труднорастворимых соединений. Произведение растворимости. Солевой эффект
Растворение твердых веществ может сопровождаться химическим изменением с образованием новых веществ, в результате чего в системе создаются новые условия.
42. Rp. Sol. Natrii bromidi 10,0:200,0 Codeini phosphatis 0,5 MDS.
Например, в процессе приготовления лекарств по рецепту 42 протекает реакция с образованием кодеина бромгидрата, растворимость которого всего 1:100 (растворимость кодеина фосфата 1:3,5).
Возможны три варианта приготовления раствора: а) в растворе натрия бромида растворяют кодеина фосфат - наблюдается появление осадка; б) в растворе кодеина фосфата растворяют натрия бромид-прозрачный раствор; в) порознь готовят растворы прописанных веществ, разделив воду на равные части,- раствор прозрачен.
В первом случае имеет место громадный избыток бром-ионов, а согласно правилу Нернста, от прибавления к раствору соли другой соли с одноименным ионом растворимость первой соли ухудшается. Из реакции:
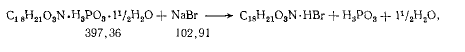
следует, что на 0,5 г кодеина фосфата расходуется всего 0.5*102.91/397.36= 0,13 г натрия бромида.
В избытке остается 9,87 г натрия бромида, а потому растворимость бромгидрата кодеина заметно ухудшается в присутствии огромного избытка бром-ионов.
По двум другим вариантам приготовления раствора бромгидрат кодеина растворяется по мере его образования и в дальнейшем удерживается в растворе.
Необходимо указать, что и по первому варианту приготовления можно получить прозрачные растворы, но при условии определенных соотношений между кодеином фосфатом и натрием бромидом.
В нашей лаборатории проверено до 20 разных сочетаний, причем установлено, что начиная с концентраций натрия бромида 1,9% и кодеина фосфата 0,095% всегда образуется осадок бромгидрата кодеина, не исчезающий и в последующие дни. При низких же содержаниях кодеина фосфата (0,03-0,095%) осадок появляется лишь в случае содержания натрия бромида выше 3%.
Произведение растворимости - произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении.
Произведение растворимости — величина постоянная. При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество.
Солевой эффект - это явление увеличения ПР осадка при добавлении сильного электролита (не содержащего одноимённых ионов).
29. Гидролиз солей. Типы гидролиза. Количественные характеристики процесса: константа и степень гидролиза
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
· 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
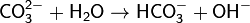
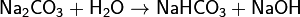
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
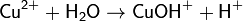
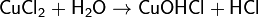
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 3. Гидролиз соли слабой кислоты и слабого основания:
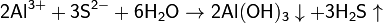

(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
См. также Электролитическая диссоциация.
Типы:
· гидролиз по катиону (в реакцию с водой вступает только катион);
· гидролиз по аниону (в реакцию с водой вступает только анион);
· совместный гидролиз (в реакцию с водой вступает и катион, и анион);
Константа гидролиза — константа равновесия гидролитической реакции. Так константа
гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
|
|
Дата добавления: 2014-11-25; Просмотров: 1360; Нарушение авторских прав?; Мы поможем в написании вашей работы!