
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Могилев, М. Е. 3 страница
|
|
|
|
Реакция возможна, так как Δ G < 0. Возможности реакции способствует огромный тепловой эффект экзотермической реакции Q = +891 кДж, несмотря на уменьшение энтропии. Изменение энтропии отрицательное, так как происходит уменьшение в три раза числа молей газообразных веществ в реакции: из трех молей газов (CH4 + 2O2) образуется один моль CO2. Вода находится в конденсированном состоянии — жидком.
2. Получение марганца восстановлением его оксида углем:
MnO2 + 2C Û Mn + 2СО
∆ Н о –520 0 0 –111 кДж/моль
∆ S о 53,1 5,74 31,8 197 Дж/(моль · К)
∆ Н о = -122 – (–520) = +298 кДж
∆ S о = 31,8 + 2 · 197 – 53,1 – 2 · 5,74 = +361 Дж/К
Δ G о = +298 – 298 · 0,361 = +190 кДж
Реакция в стандартных условиях невозможна. Однако реакция характеризуется увеличением энтропии, поэтому при нагревании значение энтропийного фактора Т∆S будет увеличиваться. Допустим, что ни ∆ Н, ни ∆ S не зависят от температуры (мало зависят). Тогда можно предположить, что Δ G будет равным нулю, когда ∆ Н = Т∆S, т. е.
298 = Т · 0,361.
Отсюда Т = 298 кДж/0,361 кДж/К = 825 К.
Т = 825 К или 552 ºС
Следовательно, при Т > 552 ºС реакция становится возможной, и этому способствует увеличение энтропии из-за образования газообразного оксида углерода (II).
Скорость химических реакций (химическая кинетика)
Химическая кинетика изучает скорости и пути протекания химических реакций.
Скоростью химической реакции называется изменение концентраций веществ реакции в единицу времени:
υ = ∆С / ∆τ
где υ — средняя скорость реакции за промежуток времени ∆τ;
∆С — изменение концентрации вещества реакции.
Скорость в данный момент, в данной временной точке равна производной концентрации по времени.
Скорость химической реакции зависит от целого ряда факторов. Основные из них следующие:
|
|
|
от природы взаимодействующих веществ;
от состояния взаимодействующих веществ;
от концентраций взаимодействующих веществ. Данная зависимость описывается законом действия масс Гульдберга и Вааге.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
В общем виде для реакции:
m A + n В →
υ = k [А]m · [В]n,
где [А] и [В] — концентрации веществ А и В.
Приведенное уравнение справедливо для реакций с участием веществ, равномерно распределенных по всему пространству сосуда и имеющих молекулярные размеры. В частности, это относится к реакциям с газообразными веществами.
Примеры
1) СО + Cl2 Û СОCl2
υ = k [СО] · [Cl2]
2) 2NO + O2 Û 2NO2
υ = k [NО]2 · [О2]
3) FeО + СО Û Fe + СО2
υ = k [СО]
Скорость зависит от давления, если участники реакции — газы.
Примеры
Допустим, в случае приведенных трех реакций увеличим в каждом случае давление в 3 раза. Тогда скорость первой реакции увеличится в 9 раз, второй — в 27 раз; а третьей — в 3 раза.
Скорость химической реакции зависит от температуры.
При нагревании увеличивается энергия молекул главным образом из-за того, что ослабляются связи в них; поэтому молекулы могут стать реакционно способными.
Энергию, которую необходимо сообщить исходным веществам для того, чтобы началась химическая реакция между ними, называется энергией активации.
Из-за наличия активационного барьера множество химических реакций оказываются замороженными. Так, рассмотренная выше реакция (с.26)
СН4 + 2О2 Û СО2 + 2Н2О
является термодинамически возможной (∆ G < 0), однако, смесь метана и кислорода при обычных условиях не реагирует. Но, когда мы поджигаем газ, мы тем самым сообщаем энергию активации исходным веществам, преодолевается при этом активационный барьер и идет активно реакция горения метана.
Существует эмпирическое правило Вант-Гоффа, заключающееся в том, что при повышении температуры на 10 ºС скорости большинства химических реакций увеличиваются приблизительно в 2–4 раза. Это правило можно выразить следующим образом:
|
|
|
V 2/ V 1 = γ (t2 - t1)/10,
где V 1 — скорость реакции при температуре t 1;
V 2 — скорость реакции при температуре t 2;
γ — температурный коэффициент реакции (≈ 2–4).
Примеры
Допустим, мы нагрели реакционную систему от 20 до 60º С и пусть γ=3. Тогда произойдет увеличение скорости в 81 раз.
Зависимость скорости химической реакции от энергии активации и температуры была показана С. Аррениусом в виде уравнения константы скорости:
k = k ' е –Еа/RT,
где k — константа скорости химической реакции;
k ' — некий коэффициент, зависящий от вероятности процесса;
е — основание натуральных логарифмов;
Е а — энергия активации;
R — универсальная газовая постоянная;
Т — абсолютная температура.
Итак, можно написать уравнение Гульдберга—Вааге—Аррениуса для скорости химической реакции так:
υ = k ' е –Еа/RTПсi,
где Псi — произведение концентраций реагирующих веществ.
Скорость химической реакции зависит часто от присутствия некотороых веществ, называемых катализаторами.
Катализаторы — вещества, участвующие в химической реакции, изменяющие ее скорость, но химически не изменяющиеся.
Каталитические реакции особенно распространены в органической химии.
Примеры
Так, реакция гидрирования этилена может происходить в присутствии катализаторов платины (Рt) или палладия (Рd) даже при обычной температуре.
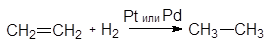 |
Синтез аммиака оказывается возможным только при участии катализаторов осмия (Os), рутения (Ru), а также железа с различными добавками:
N2 + 3Н2 Û 2NН3
Химическое равновесие
Существуют химические реакции, способные протекать как в прямом, так и в обратном направлении, т. е. не только исходные вещества реагируют друг с другом, но и получившиеся, конечные вещества также могут взаимодействовать, образуя снова исходные вещества. Такие реакции принято называть обратимыми.
Рассмотрим реакцию окисления оксида азота (II) до оксида азота (IV):
2NO + O2 Û 2NO2
Обозначим скорость реакции, идущей слева направо, через υ 1 и назовем эту реакцию прямой. Скорость реакции, идущей справа налево, обозначим υ 2:
|
|
|
υ 1 = k 1[NО]2 · [О2]; υ 2 = k 2[NО2]2.
В первоначальный момент времени, когда присутствуют только молекулы NО и О2, скорость прямой реакции υ 1 максимальна, так как максимальны исходные концентрации NО и О2. В процессе реакции их концентрации уменьшаются, что приводит к уменьшению скорости υ 1, а скорость реакции υ 2 с появлением NO2 увеличивается от нулевого значения в первоначальный момент.
Наступает момент, когда скорости становятся одинаковыми:
υ 1 = υ 2.
Это состояние системы равенства скоростей прямого и обратного процессов называется химическим равновесием.
На основании равенства скоростей υ 1 и υ 2 можно написать:
 k 1[NО]2 · [О2] = k 2[NО2]2
k 1[NО]2 · [О2] = k 2[NО2]2
Обозначим отношение констант скоростей заглавной буквой К:
К = k 1 / k 2.
Так как ни k 1, ни k 2 не зависят от концентраций веществ, то и их отношение К также от концентраций не зависит:
 |
К называется константой химического равновесия.
Химическое равновесие характеризуется целым рядом признаков:
1. При равновесии в системе не наблюдается никаких внешних изменений: ни изменения цвета; ни выпадения осадка; ни выделения газа; ни выделения или ни поглощения тепла, т. е. ни разогревания, ни охлаждения системы.
2. При постоянстве внешних условий данное состояние химического равновесия может сохраняться сколь угодно долго.
3. Состояние химического равновесия не означает прекращения процессов. Это динамическое состояние, характеризующееся непрерывным протеканием процессов в противоположных направлениях: υ 1 = υ 2.
4. Изменение внешних условий влияет на состояние равновесия. Однако при определенных, не очень грандиозных внешних воздействиях, система способна вновь придти к равновесию, так как равновесие — наиболее вероятное и наиболее энергетически выгодное состояние системы.
Результаты влияния внешних условий на равновесие можно объяснить с помощью принципа Ле Шателье, смысл которого сводится к следующему.
Если на химическую систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие, то в системе произойдут изменения, направленные на уменьшение результата внешнего воздействия.
|
|
|
Обратимся опять к системе, в которой происходит обратимая реакция:
2NO + O2 Û 2NO2
1. Пусть в систему ввели дополнительное количество кислорода. Результат этого воздействия — увеличение концентрации кислорода. Согласно принципу Ле Шателье, концентрация кислорода должна уменьшиться, а кислорода может стать меньше, если часть добавленного кислорода вступит в реакцию с NO до тех новых значений концентраций всех веществ, пока опять не наступит состояние химического равновесия.
Вывод: при добавлении веществ левой части уравнения (увеличении их концентраций) равновесие смещается вправо — в направлении прямой реакции. Соответственно вправо смещается равновесие при удалении конечных веществ, что очень часто используется в химии.
Влево равновесие смещается в результате уменьшения концентраций исходных веществ и увеличения концентраций конечных.
2. Пусть мы стали сжимать систему, т. е. увеличивать давление. Объем системы стал меньше, а количество молекул в первоначальный момент сжатия осталось прежним, но увеличилось число молекул в единице объема, т. е. давление. В соответствии с принципом Ле Шателье уменьшение давления в системе может произойти, если равновесие сместится в сторону меньшего числа молекул газообразных веществ.
В данной реакции из трех молей (трех объемов) образуются два моля (два объема) газа, т. е. в процессе прямой реакции уменьшается число молекул. Поэтому при сжатии (увеличении давления) данной системы равновесие смещается вправо.
Вывод: при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, меньшего числа молей (меньшего объема) газообразных веществ. При уменьшении давления — наоборот.
3. Рассчитаем тепловой эффект данной реакции, точнее — изменение энтальпии (∆ Н о):
2NO + O2 Û 2NO2
Из таблиц термодинамических величин находим:
∆ Н оNO = 90 кДж; ∆ Н оNO2 = 34 кДж.
Изменение энтальпии в реакции, идущей слева направо (∆Но1):
∆ Н о1= 68-180 = -112 кДж;
∆ Н о1 = -112 кДж; Q = +112 кДж.
Прямая реакция экзотермическая, что можно записать так:
2NO + O2 Û 2NO2 + 112 кДж
или
2NO + O2 Û 2NO2; ∆ Н о1 = -112 кДж.
Обратная реакция, реакция идущая справа налево, — эндотермическая. Для нее ∆ Н о2 = +112 кДж; Q = -112 кДж.
Пусть мы нагреваем систему, в которой находятся эти вещества в состоянии равновесия. Согласно принципу Ле Шателье противодействием нагреванию, выделению тепла будет реакция, идущая с поглощением тепла, т. е. эндотермическая реакция.
Вывод: при нагревании равновесие смещается в сторону эндотермической реакции; при охлаждении — в сторону экзотермической.
Равновесие рассматриваемой реакции при нагревании (повышении температуры) смещается влево — в сторону разложения NO2 на NO и O2.
Глава 5. Способы выражения концентраций веществ
в растворе
Способов выражения концентраций может быть много. Наиболее употребительны следующие:
1. Массовая доля растворенного вещества, выраженная в процентах, или процентная концентрация.
Обозначение: ω или р; г/100 г раствора
Ее можно определить как массу растворенного вещества, выраженную в граммах, содержащуюся в 100 граммах раствора.
2. Молярная концентрация или молярность.
Это количество молей растворенного вещества, содержащееся в одном литре раствора.
Обозначение: М или С М; моль/л раствора.
Задача
136 г глауберовой соли (Na2SO4 · 10H2O) растворили в 164 г воды. Получился раствор плотностью 1,19 г/мл. Какова процентная концентрация соли (Na2SO4) в растворе? Рассчитав процентную концентрацию, пересчитайте ее на молярность.
Решение задачи
1. Расчет процентной концентрации.
При растворении кристаллогидрата следует учесть то, что его кристаллизационная вода перейдет в раствор, увеличив содержание чистой воды.
Рассчитаем, сколько граммов воды из кристаллогидрата соединится со 164 г воды.
Молярная масса кристаллогидрата
M Na2SO4 = 46 + 32 + 64 + 180 = 322 г/моль.
В 322 г Na2SO4 ·10H2O содержится 142 г Na2SO4 и 18·10=180 г H2O.
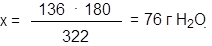 Поэтому в 136 г кристаллогидрата находится воды
Поэтому в 136 г кристаллогидрата находится воды
322 — 180
136 — xH2O
Соответственно 136 – 76 = 60 г Na2SO4.
В полученном растворе содержится 60 г Na2SO4 и 164 + 76 = 240 г H2O.
Общая масса раствора равна
60 + 240 = 300 г.
В 300 г раствора находится 60 г Na2SO4. Поэтому процентная концентрация раствора (по Na2SO4) равна:
p = 60 · 100 /300 = 20 %.
2. Следующий этап решения поставленной задачи — пересчет процентной концентрации на молярность.
Процентная концентрация – “весовая” концентрация, молярная – “объемная”. Значит, при пересчете требуется знание плотности раствора.
ρ = 1,19 г/мл.
Определим массу 1л раствора:
m 1л = 1000 мл ·1,19 г/мл = 1190 г/л.
Так как p = 20 %, то в 1л раствора содержится
m Na2SO4 = 1190 · 20 /100 = 238 г соли.
Узнаем число молей соли (n Na2SO4):
 |
А это и есть искомая молярность:
C М = 1,68 моль/л.
Глава 6. Растворы электролитов
Ионы в водном растворе
В водных растворах электролитов в результате взаимодействия электролита с молекулами воды (явление гидратации) происходит распад электролита на ионы, который называется электролитической диссоциацией. Электролитами называются вещества, способные в растворе к электролитической диссоциации.
Ионами называются заряженные частицы, несущие на себе положительный заряд (катионы) или отрицательный (анионы). Следует отличать друг от друга ионы в газе, твердом веществе и растворе.
Ионы в газе друг с другом очень мало связаны. Ионы газа не имеют близкого окружения из других частиц. Частицы газа свободно передвигаются в пространстве. Например, при высокой температуре NaCl может превратиться в газ, состоящий из ионов Na+ и Cl-.
В твердом состоянии ионы жестко связаны со своими соседями. Так, в кристалле NaCl ионы Na+ — это частицы, подвижность которых скована прежде всего ближайшими соседями — ионами хлора (Cl-), а ионы хлора окружены ионами натрия.
Ионы в растворе также не свободны, хотя значительно подвижнее ионов в твердом веществе.
В водном растворе Na+ и Cl- окружены гидратной оболочкой из молекул воды, что схематически можно представить так:
 |
Молекулы воды полярны, поэтому их можно изобразить в виде диполей:
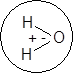 | |||
 | |||
В соответствии со сказанным изобразим уравнение электролитической диссоциации хлорида натрия в водном растворе следующим образом:
NaCl + nH2O Û Na+ · n1H2O + Cl- · n2H2O
Однако, в целях краткого написания и в связи с тем, что часто n 1 и n 2 неизвестны, и из-за того,что в химических реакциях в растворах электролитов гидратные оболочки разрушаются, пишут уравнение электролитической диссоциации упрощенно.
NaCl Û Na+ + Cl-
Но при этом обязательно подразумевается гидратная (в случае любого растворения — сольватная) природа ионов в растворе.
Гидратация (сольватация) частиц растворяемого вещества приводит к ослаблению связей между частицами в растворенном веществе, что приводит к его распаду, диссоциации и распределению гидратированных (сольватированных) частиц по всему объему раствора: действует энтропийный фактор.
Сильные и слабые электролиты
По способности электролитов распадаться на ионы в растворах часто их делят на слабые и сильные электролиты.
Сила электролита характеризуется величиной, называемой степенью электролитической диссоциации (α), которая представляет собой отношение количества молекул (молей), распавшихся на ионы, к общему количеству растворенных. Сильные электролиты имеют близкие к единице (к 100 %) величины степени электролитической диссоциации (α). Для слабых электролитов α очень мала.
Степень электролитической диссоциации зависит как от природы растворителя, так и природы растворяемого вещества — электролита. Наиболее сильно диссоциации могут подвергаться вещества, имеющие в своем составе достаточно полярные и ионные связи. Такими веществами в случае водных растворов являются основания, кислоты, соли.
Примеры сильных электролитов: NaOH, KOH, HCl, H2SO4, HNO3; растворимые в воде соли: NaCl, КCl, Na2SO4, КNO3, NH4NO3 и множество др.
Примеры слабых электролитов: NH4ОН, HNO2, H2СO3, СН3СООН, H2SO3.
При диссоциации оснований в водном растворе образуется ион гидроксила (ОН-); кислот — ион водорода (Н+); солей — катионы остатка основания и анионы кислотного остатка.
Примеры
NaОН Û Na+ + ОН- HNO3 Û Н+ + NO3-
К2SO4 Û 2К+ + SO4- - Са(HСO3)2 Û Сa++ + 2НСO3-
Помимо степени электролитической диссоциации мерой силы электролита может служить константа электролитической диссоциации (К д). Эта характеристика применяется обычно в случае растворов слабых электролитов.
Примеры
HNO2 Û Н+ + NO2-
α С α С α С
Диссоциация — процесс обратимый. Обозначим исходную концентрацию кислоты через С, а степень электролитической диссоциации — через α.
αС — число молей кислоты, распавшихся на ионы;
αС и αС — концентрации образовавшихся ионов Н+ и NO2-.
К моменту химического равновсия концентрации веществ будут равны значениям, подписанным под формулами веществ в уравнении реакции
HNO2 Û Н+ + NO2-
С - α С α С α С
Тогда константа равновесия — константа электролитической диссоциации будет равна
К д = [Н+][NO2-] /[HNO2] = α С · α С / С – α С = α2 С / 1-α
Для HNO2 К д = 4 · 10-4.
Константа мала: HNO2 — слабая кислота. Поэтому можно принебречь величиной α в знаменателе. Тогда получим
К д = α2 · С.
Так как К д не должна зависеть от концентраций, то при изменении концентрации электролита степень электролитической диссоциации также изменяется. Например, при разбавлении раствора (при уменьшении концентрации) вещества начинают лучше диссоциировать — увеличивается α.
Очень часто диссоциация электролита — в особенности это касается слабых электролитов, например, слабых кислот — происходит по стадиям, константы диссоциации которых могут сильно отличаться друг от друга.
Пример
Электролитическая диссоцияция угольной кислоты:
H2СO3 Û Н+ + HСO3- К 1 = 4,5 · 10-7,
HСO3- Û Н+ + СO3-- К 2 = 4,7 · 10-11,
К 2 << К 1.
Можно легко показать, что константа диссоцияции итогового процесса (К) равна произведению констант промежуточных стадий:
H2СO3 Û 2Н+ + СO3- -
К = К 1 · К 2 = 2,1 · 10-17.
Диссоциация воды
Вода также является электролитом, но очень слабым:
H2O Û Н+ + OН-
К д = [Н+][ОН-] /[H2O] = 1,8 · 10-16 (при 25 ºС)
Молярная концентрация воды в 1 л ее равна 1000/18,02 = 55,5 моль/л.
Из-за слабости воды как электролита количеством воды, распавшейся на ионы, можно принебречь и считать, что 1 л воды (1000 г) в целом — это 55,5 моль/л:
[H2O] = 55,5 моль/л.
Получим далее следующее:
[Н+][ОН-] = [H2O] · 1,8 · 10-16 = 55,5 · 1,8 · 10-16 = 10-14.
[Н+][ОН-] — называется ионным произведением воды и обозначается К W.
КW = [Н+][ОН-]
КW обладает свойством константы равновесия, т. е. не зависит от концентрации ионов, но оно зависит от температуры. Так, при 25 ºС КW = 10-14; при 50 ºС — 5,4 · 10-14; при 100 ºС — 55,0 · 10-14.
Это говорит о значительном ослаблении связей “О—Н” в воде при нагревании.
Итак, КW = [Н+][ОН-] = 10-14.
____
В чистой воде, а также в нейтральной среде [Н+] = [ОН-]=√10-14=10-7 моль/л концентрации ионов Н+ и ОН- должны быть одинаковы, что и вытекает из уравнения диссоциации воды
H2O Û Н+ + OН–.
Один моль воды при диссоциации образует один моль ионов Н+ и один моль ионов ОН-.
Очень часто вместо величины концентрации ионов дается показатель степени при основании 10, взятый с обратным знаком. Такие числа называют либо водородным показателем (рН), либо гидроксильным показателем (рОН).
рН = -lg [Н+] рОН = -lg [ОН-]
Для нейтрального раствора (нейтральная среда):
рН = 7 и рОН = 7,
так как [Н+] = 10-7 моль/л и [ОН-] = 10-7 моль/л.
В кислой среде — избыток ионов водорода над ионами гидроксила:
[Н+] > 10-7 моль/л; [ОН-] < 10-7 моль/л;
рН < 7; рОН > 7.
В щелочной среде:
[Н+] < 10-7 моль/л; [ОН-] > 10-7 моль/л;
рН > 7; рОН < 7.
Если прологарифмировать ионное произведение воды и поставить обратные знаки, то получим простое уравнение связи рН и рОН друг с другом:
рН + рОН = 14.
Примеры
1. Вычислить рН раствора, если [Н+] = 0,025 моль/л.
Представим [Н+] в виде 2,5·10-2. Прологарифмируем это число, изменив знак числа на обратный: – (lg 2,5 + lg 10-2) = -0,4 + 2 = 1,6.
Ответ: рН = 1,6.
2. рОН раствора равен 4,8. Какова концентрация ионов водорода в растворе?
Если рОН = 4,8, то рН = 14 – рОН = 9,2.
Далее –lg [Н+] = 9,2.
lg [Н+] = –9,2 = –9 – 0,2 = –10 + 0,8.
[Н+] = 6,3·10-10 моль/л.
3. Вычислить рН 0,001М раствора уксусной кислоты, если КД = 1,8·10-5.
Запишим уравнение реакции и обозначим концентрацию кислоты через С, а степень диссоциации — через α.
СН3СООНÛ Н+ + СН3СОО-
α С α С α С
Продиссоциирует кислота в количестве молей αС, которые превратятся в α С молей СН3СОО- и α С молей Н+.
[Н+] = α С.
Между константой диссоциации К, и С есть зависимость для слабой кислоты (с.): КД = α2 С. Умножив левую и правую части на “С”, получим
К Д· С = α2 С 2.
____ ___________
Отсюда αС = √ К Д · С = √1,8 · 10-5 · 10-3 = 1,34 ·10-4 моль/л.
[Н+] = 1,34 ·10-4 моль/л.
рН = -lg 1,34·10-4 = -0,13+4 = 3,87.
Ответ: рН = 3,87.
Ионные реакции
В растворах электролитов химические реакции происходят с участием ионов. При этом ионные равновесия смещаются в сторону связывания частиц — в сторону образования осадка или газообразного вещества, или слабого электролита — и тем сильнее, чем меньше произведение растворимости плохо растворимого электролита или чем меньше растворимость газа в растворе, или чем меньше константа диссоциации слабого электролита.
Остановимся на составлении уравнений ионных реакций, учитывая возможное смещение равновесия в растворах электролитов. Составим ионное уравнение для двух реакций.
1. Смешаем растворы азотной кислоты и гидроксида натрия. Ниже показано, что имеется в растворах до их сливания.
| Раствор кислоты | Раствор основания | |
| Н+;NO3- | Na+; OH- |
При сливании растворов произойдет связывание ионов водорода и ионов гидроксила, так как оно приводит к образованию слабого электролита — воды.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!