
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав среды
Состав водной среды. Большая часть поверхности Земли (около 366 из 510 млн км2, или 72 %) покрыто водой. Распространение и жизнедеятельность организмов в водной среде в значительной степени зависят от ее химического состава. Недостатка в воде как в химическом веществе в водных средах нет, за исключением случаев пересыхания водоемов. Тем не менее проблемы, связанные с водой, возникают даже у водных организмов.
Прежде всего водные организмы подразделяют на пресноводные и морские в зависимости от солености воды, в которой они обитают. Соленость океанской воды меняется как по глубине, так и по акватории. В Северном Ледовитом океане она ниже 31%о,[17]а в Красном море выше 42%о. Содержание солей в воде Мертвого моря достигает 26–27 %, тогда как концентрация солей в пресных водоемах около 0,05 %.
Морская вода является сложным солевым раствором со средней соленостью 35,2 г в 1 кг воды, т. е. 3,52 % по массе, или 35,2 %о.
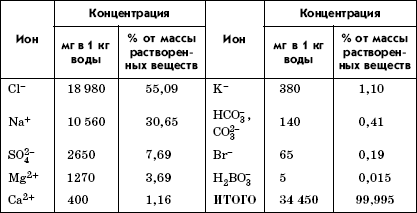
Соли и другие растворенные в воде вещества находятся преимущественно в виде ионов. Состав солей разнообразен, в океанической воде встречаются практически все химические элементы и их изотопы, но основную массу составляют девять основных ионов (табл. 3.1), соотношение между которыми постоянно и не зависит от уровня солености, места и глубины, поэтому ее можно определить по одному главному иону. Это соотношение существует давно, не менее 1 млрд лет, и акад. В. И. Вернадский предложил принять его в качестве константы для нашей планеты. Главный компонент солей морской воды – хлорид натрия, в пресных водах преобладают карбонаты.
Таблица 3. 1
Содержание ионов в морской воде
Повышение солености воды в среде обитания ведет к потере воды организмом (путем осмоса [18]).
Редкие организмы допускают большие колебания солености. Обычно они обитают в эстуариях (место впадения пресноводной реки в соленое море или длинный и узкий залив океана) или в маршах (низменная лугово‑болотная полоса вдоль морского побережья и у устья рек, заливаемая морской водой лишь при очень высоких приливах).
По составу растворенных минеральных веществ даже пресные воды могут существенно отличаться в различных природных водоемах и прежде всего в подземных и поверхностных водах. Соленость воды влияет и на наземные растения. При чрезмерно интенсивном испарении воды либо ограниченности осадков почва может засоляться. Такая проблема существует при искусственном орошении.
Любые воды в природных водоемах, помимо растворенных веществ, содержат некоторое количество взвешенных частиц, наличие которых характеризует мутность воды, ее обратную характеристику – прозрачность, а также световой режим вглубине водоема.
Один из основных комплексных показателей химического состава водной среды – кислотность (рН). Одни организмы эволюционно приспособлены к жизни в кислой среде (рН < 7), другие – в щелочной (рН > 7), третьи – в нейтральной (рН ~ 7).
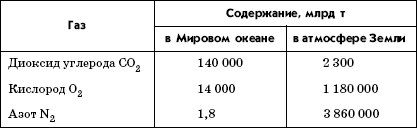
В составе природной водной среды всегда присутствуют растворенные газы, из которых первоочередное значение имеют кислород и диоксид углерода, участвующие в фотосинтезе и дыхании водных организмов (табл. 3.2). В целом масса растворенных газов почти в 30 раз меньше массы газов в атмосфере.
Колебание содержания в водах Мирового океана в предшествующие эпохи в сравнении с колебаниями концентрации углекислого газа в атмосфере показано на рис. 3.7.
Таблица 3.2
Содержание основных газов в воздухе и в воде Мирового океана
Среди прочих растворенных в океане газов наиболее заметны сероводород, аргон и метан. На отдельных участках дна сероводород образует значительные скопления. Черное море, начиная с глубины 150–200 м, является сероводородным до самого дна. Сероводородные донные участки, возможно, остались от первичного океана и населены, как и в давние времена, организмами, обходящимися без свободного кислорода (см. разд. 2.2.1.3).
Состав газов, растворенных в водах океана, близок к составу первичной атмосферы нашей планеты, в которой было заметно больше диоксида углерода и меньше кислорода.
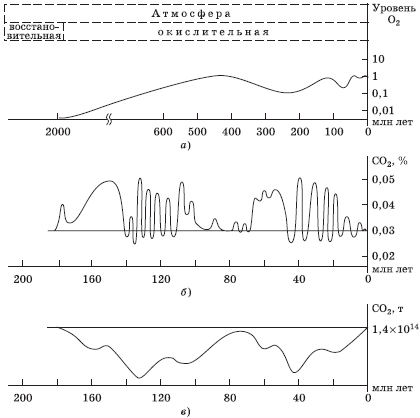
Рис. 3.7. Изменение содержания в атмосфере кислорода (а), диоксида углерода (б), а также диоксида углерода в водах Мирового океана (б) в предшествующие эпохи
Состав воздуха. Один из главных абиотических факторов наземной (воздушной) среды обитания – состав воздуха, естественной смеси газов, сложившейся в ходе эволюции Земли. Состав воздуха в современной атмосфере находится в состоянии динамического равновесия, зависящего от жизнедеятельности живых организмов и геохимических явлений глобального масштаба.
Воздух, лишенный влаги и взвешенных частиц, имеет на высоте уровня моря практически одинаковый состав во всех местностях земного шара, а также на протяжении суток и в разные периоды года. Однако в различные эпохи существования планеты состав воздуха был различен. Считается, что наиболее сильно изменялось содержание диоксида углерода и кислорода (рис. 3.7). Роль кислорода и диоксида углерода подробно показана в разд. 2.2.
Азот, присутствующий в атмосферном воздухе в наибольшем количестве, в газообразном состоянии для абсолютного большинства организмов, особенно для животных, является нейтральным. Только для ряда микроорганизмов (клубеньковых бактерий, азотобактеров, синезеленых водорослей и др.) азот воздуха служит фактором жизнедеятельности. Эти микроорганизмы усваивают молекулярный азот, а после отмирания и минерализации снабжают высшие растения доступными формами этого химического элемента.
Присутствие в воздухе иных газообразных веществ или аэрозолей (твердых или жидких частиц, находящихся в воздухе во взвешенном состоянии) в каких‑либо заметных количествах изменяет привычные условия среды обитания, влияет на живые организмы.
Состав почв. Почва – слой веществ, лежащих на поверхности земной коры. Она представляет собой продукт физического, химического и биологического преобразования горных пород (рис. 3.8) и является трехфазной средой, включающей твердые, жидкие и газообразные компоненты, находящиеся в следующих соотношениях (в %):
минеральная основа.... обычно 50–60 % от общего состава
органическое вещество................ до 10
вода...................... 25–35
воздух..................... 15–25
В данном случае почва рассматривается среди прочих абиотических факторов, хотя на самом деле она является важнейшим звеном, связывающим абиотические и биотические факторы среды обитания.
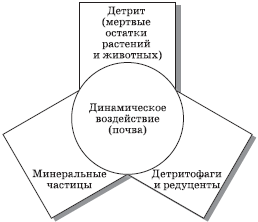
Рис. 3.8. Схема преобразования минерального вещества в почву
Минеральный неорганический состав почв ы. Горная порода под действием химических и физических факторов природной среды постепенно разрушается. Образующиеся части различны по размеру – от валунов и камней до крупных песчинок и мельчайших частиц глины. Механические и химические свойства почвы в основном зависят от мелкого грунта (частицы менее 2 мм), который принято подразделять в зависимости от размера δ (в мкм) на следующие системы:
песок....................... δ = 60–2000
алеврит (иногда называемый «пылью»)....... δ = 2–60
глину......................... δ менее 2
Структура почвы определяется относительным содержанием в ней песка, алеврита, глины и обычно иллюстрируется диаграммой – «треугольником почвенной структуры» (рис. 3.9).
Значение почвенной структуры становится понятным при сравнении свойств чистого песка и глины. «Идеальной» почвой считается состав, содержащий равные количества глины и песка в сочетании с частицами промежуточных размеров. В таком случае образуется пористая, крупчатая структура. Соответствующие почвы называют суглинками. Они имеют достоинства двух крайних типов почв без их недостатков. Большая часть минеральных компонентов представлена в почве кристаллическими структурами. Песок и алеврит состоят в основном из инертного минерала – кварца (SiO2), называемого кремнеземом.
Глинистые минералы в большинстве встречаются в виде мельчайших плоских кристаллов, часто шестигранной формы, состоящих из слоев гидроокиси алюминия или глинозема (Al2O3) и слоев силикатов (соединений силикат‑ионов SiO32– с катионами, например, алюминия А13+ или железа Fе3+, Fе2+). Удельная поверхность кристаллов очень велика и составляет 5–800 м2 на 1 г глины, что способствует удержанию воды и питательных веществ в почве.
В целом считается, что свыше 50 % минерального состава почвы составляет кремнезем (SiO2), 1–25 % – глинозем (Al2O3), 1–10 % – оксиды железа (Fe3O4), 0,1–5 % – оксиды магния, калия, фосфора, кальция (МgO, K2O, Р2O3, СаО).
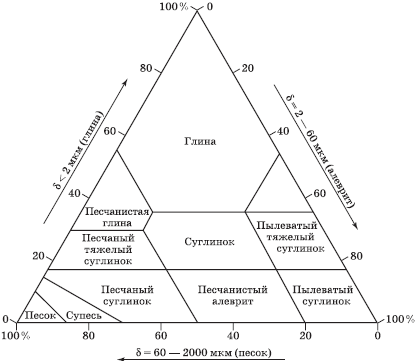
Рис. 3.9. Треугольная диаграмма классов механического состава почв: δ – размер частиц
В сельском хозяйстве почвы делят на тяжелые (глины) и легкие (пески), чем отражают величину усилий, необходимых для обработки почвы сельскохозяйственными орудиями. Ряд дополнительных характеристик минерального состава почвы будет изложен в разд. 7.2.4.
Содержание воды в почве. Вода необходима всем почвенным организмам, она поглощается корнями растений и принимает участие в процессах разрушения материнской породы, подстилающей почву. Благодаря воде происходит миграция и дифференциация химических элементов в почве. Более правильно жидкую часть почвы рассматривать как почвенный раствор.
Общее количество воды, которое может быть удержано почвой, складывается из гравитационной, физически связанной, капиллярной, химически связанной и парообразной воды (рис. 3.10).
Грабитационная бода может свободно просачиваться вниз через почву, достигая уровня грунтовых вод, что ведет к вымыванию различных питательных веществ.
Физически сбязанная (гигроскопическая) бода адсорбируется на частицах почвы в виде тонкой прочно связанной пленки. Ее количество зависит от содержания твердых частиц. В глинистых почвах такой воды значительно больше (около 15 % веса почвы), чем в песчаных (около 0,5 %). Гигроскопическая вода наименее доступна растениям.
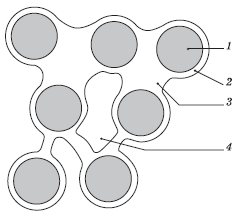
Рис. 3.10. Типы почвенной воды, доступной корням растений (по Н. Грину, У. Стауту, Д. Тейлору): 1 – частицы почвы; 2 – гигроскопическая вода; 3 – капиллярная вода; 4 – воздух или гравитационная вода
Капиллярная вода удерживается вокруг почвенных частиц за счет сил поверхностного натяжения. При наличии узких пор или канальцев капиллярная вода может подниматься от уровня грунтовых вод вверх, играя центральную роль в регулярном снабжении растений влагой. Глины удерживают больше капиллярной воды, чем пески.
Химически связанная вода и парообразная практически недоступны корневой системе растений.
Содержание воздуха в почве. Поры почвы, не занятые водой, заполняет почвенный воздух. Насыщенность воздухом (аэрация) играет важную роль в почвенных процессах. С увеличением размера частиц грунта объем пор возрастает.
По сравнению с составом атмосферного воздуха из‑за дыхания организмов с глубиной уменьшается содержание кислорода (до 10 %) и увеличивается концентрация диоксида углерода (достигая 19 %). В течение года и суток состав почвенного воздуха сильно меняется. Тем не менее почвенный воздух постоянно обновляется и пополняется за счет атмосферного.
Заболачивание почвы обусловливает вытеснение воздуха водой, и условия становятся анаэробными. Так как микроорганизмы и корни растений продолжают выделять СО2, образующий с водой Н2СО3 (угольную кислоту), то замедляется обновление гумуса и накапливаются гуминовые кислоты. Все это повышает кислотность почвы, которая, наряду с истощением запасов кислорода, неблагоприятно отражается на почвенных микроорганизмах. Длительные анаэробные условия ведут к отмиранию растений.
Характерный для заболоченных почв серый оттенок придает восстановленная форма железа (Fe2+), окисленная форма (Fe3+) окрашивает почву в желтый, красный и коричневый цвета.
|
|
Дата добавления: 2014-11-25; Просмотров: 3489; Нарушение авторских прав?; Мы поможем в написании вашей работы!