
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електрохімічна корозія
|
|
|
|
Електрохімічна корозія відбувається у випадку, коли поверхня металу контактує з будь-яким електролітом, і супроводжується процесом розчинення металів в електролітах в результаті дії гальванічних пар, що утворюються.
Суть процесу аналогічна роботі гальванічного елемента (рис.11). Якщо метал не є однорідним, окремі його ділянки мають різну здатність до розчинення. Чим лівіше розташований метал у ряду напруженості, тим легше він розчиняється в електроліті. Певні ділянки поверхні апарата, стикаючись з електролітом, стають анодом, інші – катодом.

Рис.11. Схема взаємодії металів з електролітом: 1 – катод (не розчиняється); 2 – анод (розчиняється); 3 – електроліт
Якщо неоднорідний метал занурити в електроліт, то іони більш активного металу будуть переходити в розчин. Ділянка обладнання, поверхня якого є анодом, буде руйнуватися. Негативні іони електроліту переміщаються в напрямку позитивно заряджених іонів металу, що виділяються і, з’єднуючись із ними, утворюють хлористу сіль металу. У той же час позитивно заряджені іони електроліту (водню) переміщаються до негативно заряджених ділянок стінки і, нейтралізуючись, утворюють молекулу водню. Кількість металу, що розчинився ( ), визначають за формулою:
), визначають за формулою: 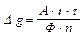 ,
,
де – корозійний струм, А; Ф – стала Фарадея, Ф = 96500 Кл/моль; А – атомна маса металу, г; n – валентність іона металу, що переходить у розчин; – тривалість корозії, с.
До електрохімічної корозії відноситься:
· атмосферна корозія, що проходить у вологому повітрі, яке має домішки агресивних парів та газів;
· корозія в розчинах кислот, лугів, солей тощо;
· корозія в розплавлених солях;
· ґрунтова корозія;
· корозія блукаючими струмами.
|
|
|
Заходи для запобігання пошкоджень технологічного обладнання в результаті руйнування металу від впливу корозії:
· застосування корозійностійких матеріалів (бронза в середовищах із розчинами солей, титан у розчинах оцтової кислоти; нержавіючі сталі в окисних середовищах, алюміній у 40% розчині мурашиної кислоти тощо);
· ізоляція металу від агресивного середовища захисними покриттями (покриття лаками, фарбами, застосування бітумно-пекових обмазок для захисту від ґрунтової корозії, нанесення тонких металевих плівок і футерівки (керамічна плитка, пластмаса тощо);
· зменшення корозійної активності середовища (очищення речовин, що обробляються від агресивних домішок; введення інгібіторів у грунт (нітрати, фосфати та ін.); осушення місць встановлення технологічного обладнання);
· застосування неметалевих хімічно стійких матеріалів(поліетилену, поліпропілену, фторопластів, скла, кераміки);
· застосування установок катодного захисту проти електрохімічної корозії тощо.
Захист від електрохімічної корозії базується на ліквідації анодних ділянок, що можуть виникати на поверхні технологічного обладнання.
Катодний (мал.12) і протекторний захист (мал.13) дає можливість створити різницю потенціалів між спорудою, що захищається, і ґрунтом. При цьому вся споруда стає катодом.
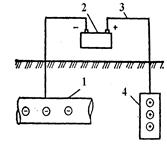

Рис.12. Рис.13.
Рис.12. Катодний захист: 1 – підземний трубопровід (катод), який захищається; 2 – джерело постійного стуму; 3 – з’єднувальні проводи; 4 – металолом (анод)
Рис.13. Протекторний захист: 1 – протектор; 2 – підземний трубопровід; 3 – з’єднувальні проводи
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 680; Нарушение авторских прав?; Мы поможем в написании вашей работы!