
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
III. Гидролиз по катиону и аниону
|
|
|
|
II. Гидролиз по аниону
а) анион однозарядный:
NaCN + HOH «NaOH + HCN
Na+ + CN– + HOH «Na+ + OH– + HCN
CN– + HOH «OH– + HCN
б) анион многозарядный:
К3РО4 «3K+ + 
K3PO4 + HOH «KOH + K2HPO4
3K+ +  + HOH«K+ + OH– + 2K+ + H
+ HOH«K+ + OH– + 2K+ + H 
(1-ая ступень гидролиза)
 + HOH «OH– +H
+ HOH «OH– +H 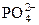
Гидролиз по аниону приводит к связыванию ионов водорода от воды к накоплению ОН–, среда щелочная, pH>7.
Он наблюдается при смешивании растворов солей слабого основания и слабой кислоты:
2AlCl3 + 3Na2S + 6HOH = 2Al(OH)3¯ + 3H2S + 6NaCl
Соли, гидролизующиеся и по катиону, и по аниону в растворе, как правило, не существуют, так как они полностью разлагаются водой, образуя слабое основание и слабую кислоту. Полнота гидролиза характеризуется степенью гидролиза h, которая показывает отношение числа гидролизованных молекул к общему числу растворенных молекул.
Вода – слабый электролит, поэтому молекулы ее в незначительной степени диссоциируют на ионы: Н2О «Н+ + ОН–. Свободные ионы водорода не способны к существованию в водном растворе, они быстро гидратируются до катионов гидроксония Н3О+
Н+ + Н2О «Н3О+
Для простоты записи часто используют обозначение Н+.
В 1 л чистой воды при t = 250 концентрация ионов Н+ и ОН– равны и каждый составляет 10–7 моль/л.
Ионное произведение воды ( ) – это произведение концентраций ионов Н+ и ОН– в воде и в разбавленных водных растворах при (
) – это произведение концентраций ионов Н+ и ОН– в воде и в разбавленных водных растворах при ( ). При 250С значение
). При 250С значение  равно:
равно:
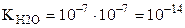 .
.
В водных растворах электролитов молярные концентрации ионов Н+ и ОН– ни всегда равно 10–14. Если известно значение [H+], то значение [OH–] можно определить так:
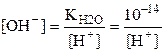 ;
;  .
.
Изменение концентраций ионов Н+, а следовательно и ионов ОН– приводит к изменению кислотности или щелочности среды:
в кислой среде [H+] >10–7 моль/л; [OH–] <10–7 моль/л;
в щелочной среде [H+] <10–7 моль/л; [OH–] >10–7 моль/л;
|
|
|
в нейтральной среде [H+] =10–7 моль/л; [OH–] =10–7 моль/л.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1534; Нарушение авторских прав?; Мы поможем в написании вашей работы!