
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Фарадея
|
|
|
|
Катод – это электрод, на котором происходит процесс восстановления катионов электролита.
Отрицательно заряженные ионы электролита (анионы) подходят к положительному электроду и окисляются на его поверхности, отдавая избыточные электроны.
Анод – это электрод, на котором происходит процесс окисления анионов электролита.
Таким образом, в процессе электролиза катод выполняет функцию восстановителя, а анод – окислителя.
В отличие от гальванических элементов при электролизе отрицательным полюсом является катод (К), а положительным полюсом – анод (А).
Количественно электролиз можно описать законом электролиза.
Первый закон Фарадея: массы веществ, выделяющихся на электродах прямо пропорциональны количеству электричества (q), протекающего через расплав или раствор электролита.
Математическое выражение:
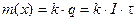 ,
,
где: т (х) – масса выделенного на электроде вещества, г; q – количество электричества, Кл, А×ч; I – сила тока, А; t – время прохождения тока.
Второй закон Фарадея: при пропускании через растворы различных электролитов равного количества электричества массы вещества, выделенных на электродах, пропорциональны молярным массам их эквивалентов.
m(х) =  .
.
Литература:
1. Кубасов В.Л., Зарецкий С.А. Основы электрохимии.- М.: Химия, 1988.
2. Новиков Г.И. Основы общей химии. -М.: Высшая школа, 1988.
Лекция №14. Химия элементов
План лекции
1. Свойства р -металлов и их соединений.
2. Свойства переходных металлов. d-элементы IV-VIII групп.
3. Углерод и его аллотропные формы.
К р - металлам относятся алюминий Al и элементы подгруппы галлия – галлий Ga, индий In, таллий Tl, их атомы имеют ns2np1-конфигурацию валентных электронов.
По сравнению с бором атомы этих элементов имеют больший радиус и меньшее значение энергии ионизации. В группе IIIА при переходе к таллию возрастают металлические свойства.
|
|
|
Алюминий химически активен, уже в обычных условиях на воздухе покрывается оксидной пленкой. О высокой восстановительной активности алюминия свидетельствуют значения его стандартного электродного потенциала в кислой и щелочной средах:
Al – 3  = Al3+, E0 = –1,66B;
= Al3+, E0 = –1,66B;
Al + 6OH– –3  = [Al(OH)6]3–, E0 = –2,35B.
= [Al(OH)6]3–, E0 = –2,35B.
Алюминий легко взаимодействует с водой после удаления с него оксидной пленки, выделяет водород из соляной и разбавленной серной кислот, устойчив в очень разбавленной азотной кислоте и концентрированных растворах азотной и серной кислот при комнатной температуре, легко растворяется в растворах щелочей с образованием анионного комплекса [Al(OH)6]3–. В своих соединениях алюминий проявляет степень окисления +3.
Оксид и гидроксид алюминия амфотерны с преобладанием основных свойств.
Соли алюминия, образованные сильными кислотами, сильно гидролизованы в водных растворах и имеют кислую реакцию. Соли слабых кислот (Al2S3, Al2(CO3)3 и др.) необратимо гидролизуются до Al(OH)3.
В комплексных соединениях, образованных ионом Al3+ в степени окисления +3 основано на малой растворимости в воде ортофосфата алюминия, а также на адсорбционной способности гидроксида алюминия.
Соединения алюминия находят разнообразное применение: в текстильной промышленности используются его хлорид, сульфат, нитрат. Алюмокалиевые квасцы KAl(SO4)2×12H2O, применяются как протрава при крашении. Сульфат алюминия Al2(SO4)3 ×18H2O используется для очистки воды.
К р - металлам относятся олово Sn и свинец Pb IVA-группы. Олово и свинец образуют два типа оксидов: МеО и МеО2. Они практически нерастворимы в воде, их гидроксиды получаются при действии щелочей на соли соответствующих металлов. SnO и PbO и соответствующие им гидроксиды Sn(OH)2 и Pb(OH)2 – амфотерны. Они образуют два ряда солей (катионного и анионного типа): SnCl2 – хлорид олова (II); Pb(NO3)2 – нитрат свинца (II); Na2[Sn(OH)4] – тетрагидроксостаннат натрия (II); Na2[Pb(OH)4] – тетрагидроксоплюмбат натрия (II).
|
|
|
Комплексные соединения анионного типа дегидратируются (обезвоживаются) и переходят в мета-форму: Na2SnO2 и Na2PbO2. Высшие оксиды SnO2 и PbO2 также являются амфотерными.
Для качественного определения соединений олова используется их способность быть восстановителями:
Sn2+ – 2  ® Sn4+, E0 = –0,15B.
® Sn4+, E0 = –0,15B.
Для определения ионов свинца (II) используются различные реакции образования нерастворимых соединений свинца (II), а для обнаружения ионов свинца (IV) – окислительная способность соединений свинца (IV), имеющих высокий окислительный потенциал:
PbO2 + 4H+ + 2  ® Pb2+ + 2H2O, E0 = 1,46B.
® Pb2+ + 2H2O, E0 = 1,46B.
Некоторые соединения олова и свинца очень неустойчивы и чрезвычайно ядовиты.
Металлы d-элемента VIII групп – это железо, кобальт, никель. Для Fe, Co, Ni характерны степени окисления +2 и +3; при переходе от Fe к Ni устойчивость состояния в степени окисления +2 увеличивается, а в степени окисления +3 уменьшается. Степень окисления +6 известна только для Fe.
Железо – металл средней активности, в ряду Fe – Co – Ni химическая активность постепенно снижается, что можно объяснить заполнением d-подуровня и увеличением его устойчивости
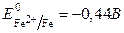 ;
; 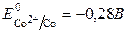 ;
;  .
.
Углерод находится в IVA-группе периодической системы. В свободном состоянии углерод химически пассивен. Как простое вещество он может существовать в виде четырех модификаций: алмаза, графита, аморфного углерода и полимерного углерода – карбина. Наиболее устойчивой модификацией является графит. В своих соединениях углерод проявляет степени окисления –4 (в углеводородах типа СН4), –2 (в спиртах типа СН3ОН), 0 (в альдегидах типа Н2СО), +2 (в карбоновых кислотах типа НСООН и в СО) и +4 (в СО2 и его производных).
Молекула СО за счет неподеленной пары электронов углерода проявляет способность к реакциям присоединения, в частности, с d-металлами, образуя при этом комплексы, называемые карбонилами: [Cr(CO)6], [Fe(CO)5], [Ni(CO)4] и др.
Диоксид углерода СО2 является кислотным, ему соответствует слабая двухосновная угольная кислота, имеющая следующие константы диссоциации: К1 = 4,3×10–7, К2 = 4,7×10–11.
|
|
|
Литература:
1. Новиков Г.И. Основы общей химии. -М.: Высшая школа, 1988.
2. Глинка П.Л Общая химия.– Л.: Химия, 1984.
Лекция №15
Химия и охрана окружающей среды. Коррозия металлов
План лекции
1. Роль химии в охране окружающей среды.
2. Сущность коррозии металлов в различных средах.
В настоящее время объем выбросов загрязняющих веществ антропогенного действия соизмерим с масштабами природных процессов миграции и аккумуляции различных соединений органического и неорганического происхождения. Влияние загрязняющих веществ на воду, атмосферу и почву испытывает не только население крупных городов, но и жители сельских местностей. В настоящее время во многих странах мира особое внимание уделяют чистоте атмосферного воздуха, питьевой воды, продуктов питания, кормов. За нарушение установленных нормативов применяются жесткие санкции, особенно в развитых странах Евросоюза. Но экологические проблемы всегда будут актуальными при любом уровне экономического развития. Поэтому, требования к снижению опасных уровней содержания поллютантов и борьбе с токсикологическими ситуациями со временем будут возрастать.
Основными причинами загрязнения природных вод в Южно - Казахстанской области (ЮКО) являются следующие источники:
– загрязнение промышленными стоками, которые образуются при деятельности нефтяной и газовой промышленности, химического и металлургического производства, целлюлозно-бумажного производства, причем нормативно-чистые промышленные стоки сбрасываются в нагретом состоянии, что ведет к термическому загрязнению природных вод;
– загрязнение коммунальными стоками, хотя эти воды и подвергаются очистке в отстойниках, биологических прудах, на полях орошения, где накапливаются осадки сточных вод, в которых содержатся ионы тяжелых металлов, другие токсические компоненты, нефтепродукты в количествах, превышающих предельно допустимые концентрации (ПДК);
– загрязнение нефтью и нефтепродуктами, которые образуются при добыче и переработке, при авариях, после взрывов и пожаров и при их транспортировке;
|
|
|
– загрязнение поверхностными водами, образующимися в процессе таяния снега, дождевыми водами, которые выносят в реки все характерные загрязняющие вещества с территории промышленных предприятий, городов, с сельскохозяйственных угодий – остатки навоза, патогенные микроорганизмы, ядохимикаты, пестициды, фунгециды и т.п.;
– загрязнение сточными водами шахт и рудников, минерализованными дренажными водами с орошаемых земель.
В настоящее время особую опасность для природных вод приобретает загрязнение разнообразными моющими средствами, которые применяются в железнодорожных, автомобильных и речных видах транспорта, а также в быту.
Кроме вышеприведенных источников загрязнения природных вод загрязнителями являются также токсические вещества, содержащиеся в атмосферных выпадениях, в виде «кислых дождей». На наземные биогеоценозы оказывает влияние отвалы-терриконы теплоэлектростанций, нефтедобычи, газодобычи, сбросы солевых растворов, концентрированных кислот и другие.
Определенная часть этих загрязняющих веществ тем или иным путем попадают в природные воды.
На территории Южно-Казахстанского региона насчитывается 118 малых и больших рек протяженностью от 6 до 200 км. Санитарно- эпидемиологическое состояние этих рек на самом низком уровне, особенно в районах населенных пунктов и промышленных объектов. По данным санитарно-эпидемиологической службы состояние и качество природной питьевой воды, потребляемой населением области, не отвечает установленным нормативам. Особенно проблема чистой воды остро ощущается в Арысском, Отрарском и Сузакском районах и в г. Шардаре, где наиболее часто наблюдаются случаи вспышек кишечно-желудочных заболеваний и гепатита.
Коррозия металлов – это необратимое разрушение металлов и сплавов вследствие химического или электрохимического воздействия окружающей среды. Коррозия является неконтролируемым окислительно - восстановительным процессом, при котором металл, теряя электроны окисляется:
Me – n  ® Мпп+
® Мпп+
По механизму протекания различают химическую и электрохимическую коррозию. Разновидностью химической коррозии является высокотемпературная газовая коррозия.
Сущность химической коррозии сводится к прямому взаимодействию металла с окислителями (сухие газы О2; Cl2, N2, органические вещества и др.) в отсутствии электролита или влаги. При этом окисление металла идет по механическому механизму: адсорбирующийся на поверхности металла окислитель (например, О2 или С12) оттягивает электроны от металла, образуя поверхностные соединения в виде оксидов, хлоридов и т.д.:
2Ме + О2 = 2МеО; 2Ме + ЗС12 = 2МеС1
Электрохимическая коррозия совершается по электрохимическому механизму в условиях наличия на поверхности металла слоя электролита (растворы солей, кислот или щелочей, атмосферная влага, почва, морская вода и т.п.)
Сущность электрохимической коррозии заключается в том, что процесс окисления (коррозии) металла сопровождается полным удалением валентных электронов атома металла и передачей их другой частице - деполяризатору. В качестве деполяризатора служат ионы водорода (коррозия с водородной деполяризацией), молекулярный кислород (коррозия с кислородной деполяризацией), или другие окислители.
При электрохимической коррозии на металле идут одновременно два процесса:
1. Окисление метала (анодный процесс)
Me – n  ® Мпп+
® Мпп+
2. Восстановление окислителя (катодный процесс)
а) 2Н + 2  ® Н2 (в случае коррозии с водородной деполяризации);
® Н2 (в случае коррозии с водородной деполяризации);
б) О2 + 2Н2О + 4  ® 4ОН– (в случае коррозии с кислородной деполяризацией).
® 4ОН– (в случае коррозии с кислородной деполяризацией).
Коррозия с водородной деполяризацией протекает в тех случаях, когда потенциал водородного электрода положительнее потенциала металла (среда раствора электролита кислая). Коррозия с кислородной деполяризацией возможна, если потенциал кислородного электрода положительнее потенциала металла (среда раствора электролита нейтральная или щелочная).
Одним из наиболее надежных и распространенных методов предохранения металлов от коррозионного разрушения является нанесение защитных покрытий: металлических (анодное, катодное покрытие), лакокрасочных, оксидных и других. В последние годы широкое применение нашли ингибиторы коррозии – вещества которые, находясь к небольших количествах в агрессивной среде, обеспечивают эффективную защиту металла.
Важнейшим условием надежности защитного действия любого вида покрытия или ингибитора является равномерность распределения последних по всей поверхности, высокая адгезия покрытия к поверхности защищаемого металла. Эти условия достигаются тщательной очисткой и подготовкой поверхности изделия, правильным выбором метода и строгим соблюдением технологического режима нанесения покрытия или применения ингибитора.
Пример. Как происходит коррозия железа, находящегося в контакте с оловом в нейтральной среде? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. 1. Найдем стандартные электродные потенциалы железа и олова:
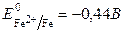 ;
;  .
.
2. Так как  , то олово является катодом, а железо – анодом.
, то олово является катодом, а железо – анодом.
3. На аноде идет процесс окисления:
Fe – 2  ® Fe2+
® Fe2+
На катоде (олово) идет процесс восстановления:
O2 + 2H2O + 2  = 2OH–
= 2OH–
Так как ионы Fe2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2, который под воздействием кислорода воздуха окисляется до Fe(OH)3.
Литература:
1. Глинка П.Л Общая химия.– Л.: Химия, 1984.
Валентина Федоровна Мясникова
Эльмира Нуриддиновна Абдулова
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1710; Нарушение авторских прав?; Мы поможем в написании вашей работы!