
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тогда для произвольной массы газа получим
|
|
|
|
dQ=dU=  . (2.13)
. (2.13)
Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа при расширении объема от V1 до V2 равна
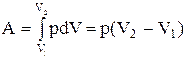 (2.14)
(2.14)
и определяется площадью прямоугольника, выполненного в цвете на рис. 60. Если использовать уравнение Клапейрона - Менделеева для выбранных нами двух состояний, то
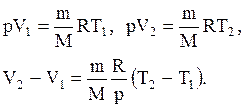
Тогда выражение (2.14) для работы изобарного расширения примет вид
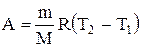 . (2.15)
. (2.15)
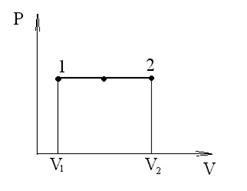
Рис. 60
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если Т2-T1 =1 К, то для 1 моля газа R = А, т.е. R численно равна работеизобарного расширения 1 моля идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой m количества теплоты

его внутренняя энергия возрастает на величину (согласно формуле (2.9)).
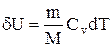 .
.
При этом газ совершит работу, определяемую выражением (2.14).
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля - Мариотта: PV=const.
Диаграмма этого процесса (изотерма)в координатах р, V представляет собой гиперболу (рис. 46), расположенную на диаграмме тем выше, чем выше температура, при которой происходил процесс.
Исходя из выражений (2.5) и (2.9) найдем работу изотермического расширения газа:
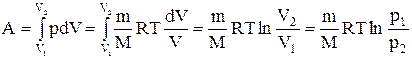 .
.
Так как при T=const внутренняя энергия идеального газа не изменяется
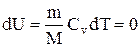
то из первого начала термодинамики (dQ=dU+dA) следует, что для изотермического процесса
dQ=dA,
т.е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
 . (2.16)
. (2.16)
Следовательно, для того, чтобы при работе расширения температура не уменьшалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!