
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная и мольная (эквивалентная) электропроводность
|
|
|
|
Электропроводность растворов электролитов.
Способность вещества проводить электрический ток наз. электропроводностью. Она характеризуется величиной обратной сопротивлению раствора L = 1/R = c – удельная электропроводность.
Удельная электропроводность электролита (c) – величина обратная сопротивлению столба раствора длиной в 1 м и площадью в 1 м2.
Т. к. передача электричества осуществляется посредством движения ионов, то удельная электропроводность раствора тем выше, чем больше их концентрация и скорость движения. Чистая вода, вследствие ничтожно малой степени диссоциации на ионы почти не обладает проводимостью. Проводимость возникает при добавлении к воде первых порций электролита и увеличивается по мере добавления новых. Когда концентрация раствора становится достаточно большой, то в случае сильных электролитов возрастает взаимное притяжение ионов, приводящее к снижению их подвижности, а в случае слабых электролитов происходит снижение их степени диссоциации. Это приводит к тому, что начиная с определенной концентрации удельная электропроводность раствора начинает уменьшаться.
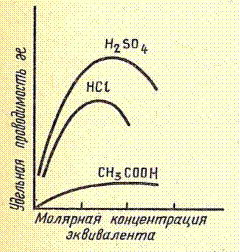
| Удельная электропроводность растворов электролитов также зависит и от индивидуальных свойств ионов. Это связано с тем, что количество переносимого ионами электричества в растворе электролита зависит не только от числа ионов в единице объема, но и от скорости их движения. |
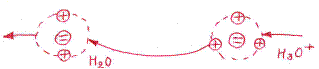
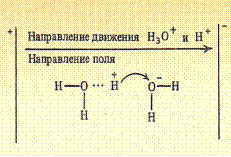
Скорость движения большинства ионов, за исключением ионов гидроксония (Н30+) и гидроксила (ОН-) имеет приблизительно одинаковую величину. Ионы гидроксила движутся в несколько раз быстрее, а гидроксония еще быстрее, чем все остальные ионы. Высокая подвижность ионов гидроксония объясняется тем, что протоны в водных растворах кислот не закреплены за определенными молекулами воды, с которыми они образуют ионы гидроксония Н3О+, а постоянно переходят с одной молекулы воды на другую. Электрический ток переносится скачкообразным переходом протонов Н+ от ионов Н30+ к соседним молекулам воды (эстафетный механизм).
|
|
|
| 
|
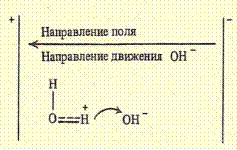
Совершенно аналогичным образом, переходом протонов от молекул воды к иону ОН- объясняется кажущееся движение гидроксил-ионов в обратном направлении:

| 
|
Поскольку отрыв протона от молекулы воды происходит труднее, чем его переход от гидроксоний-катиона к воде, то подвижность ОН- ионов несколько меньше, чем подвижность ионов гидроксония.
Именно этим объясняется значительно большая электропроводность водных растворов кислот и оснований, по сравнению с электропроводностью растворов солей при равных концентрациях.
Для объяснения свойств электролитов удельная электропроводность представляет собой величину малоудобную, т. к. зависит от многих факторов. Но зато эта величина легко может быть измерена. Преобразовав ее можно перейти к более удобной для расчетов величине – мольной (эквивалентной) электропроводности l.
Мольной (эквивалентной) электропроводностью называют электропроводность столба раствора, содержащего 1 г-экв. растворенного вещества, заключенного между электродами, находящимися друг от друга на расстоянии в 1 м.
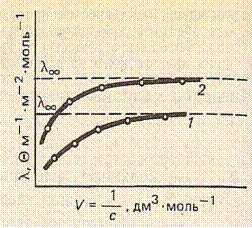
Мольная (эквивалентная) электропроводность у сильных и слабых электролитов возрастает с увеличением разбавления (с уменьшением концентрации) и достигает некоторого предельного значения, которое наз. электропроводностью при бесконечном разбавлении (l¥).
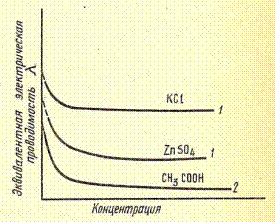
| 
|
Это объясняется тем, что по мере разбавления растворов в случае слабых электролитов растет степень электролитической диссоциации, а в случае сильных – происходит увеличение расстояния между ионами, в результате чего силы взаимного притяжения ослабевают и скорость движения ионов увеличивается.
|
|
|
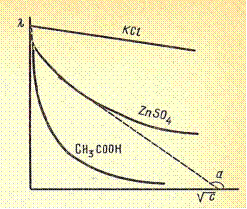
| Если построить зависимость l = С, то для слабых электролитов в области больших разбавлений получится кривая, а для сильных – прямая линия. |
Для разбавленных растворов (концентрацией не выше 0,002 н) сильных электролитов зависимость l от С довольно хорошо описывается эмпирическим уравнением Кольрауша:
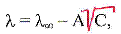
где А – константа, зависящая от природы растворителя, температуры и валентности электролита.
Кольрауш вывел закон независимости движения ионов (закон Кольрауша) – эквивалентная электропроводность электролита при бесконечном разбавлении равна сумме подвижностей катиона и аниона.
l¥ = l¥+ + l¥-,
где l¥+ и l¥- – подвижности ионов при бесконечном разбавлении.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1969; Нарушение авторских прав?; Мы поможем в написании вашей работы!