
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Іонний зв’язок
|
|
|
|
В результаті електростатичного притягування протилежно заряджених іонів виникає іонний зв’язок. Іони можуть бути простими (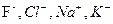 ) і складними (
) і складними ( ). Прості іони з позитивним зарядом легше всього утворюються із атомів елементів з низьким потенціалом іонізації. Потенціал іонізації - енергія відриву електрону від атома (розрізняють 1-й і 2-й потенціал іонізації). До таких елементів відносяться метали головної підгрупи 1-ї та 2-ї груп.
). Прості іони з позитивним зарядом легше всього утворюються із атомів елементів з низьким потенціалом іонізації. Потенціал іонізації - енергія відриву електрону від атома (розрізняють 1-й і 2-й потенціал іонізації). До таких елементів відносяться метали головної підгрупи 1-ї та 2-ї груп.
Прості іони з від’ємним зарядом утворюються з атомів типічних неметалів, які мають велике значення спорідненості до електрону.
Іонний зв’язок не має направленості, так як електичне поле має сферичну форму, тобто зменшується по одному й тому ж закону в будь-якому напрямку.
Іонний зв’язок не характризується насиченістю, тобто до даного іону можна приєднати різне число іонів протилежного знаку, це число визначається відносними розмірами взаємодіючих іонів. В іонних сполуках можливе неповне розподілення зарядів, що пояснюється взаємною поляризацією іонів, тобто впливанням один на одного, створюваних ними електронних полів. Кожен іон, будучи носієм заряду, є джерелом електричного поля. Поляризація різних іонів неоднакова, чим слабше зв’язані зовнішні електрони з ядром, тим легше поляризується іон. В ряду: Li<Na<K<Rb<Cs - збільшується поляризація, зменшується поляризаційна здатність. Поляризаційна здатгість іонів залежить від заряду і розміру іона.Чим більше заряд іона, тим сильніше утворювані ним електричне поле. Значить найбільшою поляризацією характризуються багатозарядні іони.
Із усього можна зробити висновок, що іонний зв’язок можна розглядати не як особливий вид зв’язку, а як граничний випадок ковалентного зв’язку.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 700; Нарушение авторских прав?; Мы поможем в написании вашей работы!