
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція VIі. Розчини. Властивості розведених розчинів неелектролітів та електролітів
|
|
|
|
План:
1. Розчини. Класифікація розчинів.
2. Способи вираження концентрації розчинів.
3. Теорія електролітичної дисоціації. Процес дисоціації. Ступінь та константа дисоціації слабких електролітів.
4. Сильні електроліти. Іонно-молекулярні рівняння.
5. Дисоціація води. Водневий показник середовища.
6. Гідроліз солей.
1. Розчини – гомогенні (однорідні) системи, що складаються з двох або більше компонентів відносні кількості яких змінюються в широких межах. Кількісно переважаючий компонент – розчинник, компонент розчину, що знаходиться в меншій кількості – розчинна речовина. Розчини мають у всіх своїх частинах однакові хімічні і фізичними властивостями.
Розчини класифікують:
а) за кількістю розчиненої речовини:
· насичені (це такі розчини, що знаходяться в стані рівноваги з розчиненою речовиною, тобто швидкість процесів розчинення і кристалізації однакова);
· ненасичені (концентрація розчиненої речовини менше, чим у насиченому розчині);
· перенасичені (розчин містить значно більше розчиненої речовини, чим потрібно для насичення при даній температурі).
Перенасичені розчини були відкриті в 1794 році російським академіком Т.Е. Ловіцем. У спокійному стані вони можуть стояти протягом років без зміни. Але, якщо занурити в розчин кришталик цієї ж розчиненої речовини, навколо нього почнуть виростати кристали і процес буде продовжуватися до тих пір, поки весь надлишок не викристалізується. Легко утворюють перенасичені розчини: Na2SO4 . 10H2O (глауберова сіль);
Na2B4O7 . 10H2O (бура);
Na2S2O3 . 5H2O (тіосульфат натрію).
б) за агрегатним станом:
· газоподібні;
· рідкі;
· тверді (кольорові стекла, коштовні камені).
Особливий інтерес для фахівців з профілю «агрономія» представляють рідкі розчини, оскільки основною складовою частиною тваринних і рослинних організмів є водні розчини різних речовин.
|
|
|
В даний час не існує теорії розчинів, розробленої досить досконало, щоб можна було в будь-якому випадку визначати властивості розчину за властивостями його компонентів і складом. З усіх розчинів найбільш вивчені розбавлені. У розведених розчинах частки розчиненої речовини настільки відділені одна від одної молекулами розчинника, що взаємодія між ними дуже слабка і хімічна природа розчиненої речовини практично не впливає на властивості розведеного розчину. Цим пояснюється той факт, що властивості розчинів не залежать від складу частин розчиненої речовини і їхніх розмірів і визначаються тільки концентрацією розчину, тобто числом частин в одиниці об'єму. Кількісні закономірності, що пов'язують концентрацію розчину з осмотичним тиском, тиском насиченої пари, температурою кипіння і замерзання встановлені наприкінці XIX століття вченими Раулем, Вант-Гоффом, Арреніусом.
2. Найбільш важливою характеристикою розчинів є концентрація (активність). Історично склалося декілька способів вираження концентрації.
1. Масова частка, С %, - відношення маси розчиненої речовини m до загальної маси розчину - m1. Масову частку можна виражати в частках одиниці, але найчастіше виражають у відсотках

Приклад: у 300 г розчину міститься 60 г розчиненої речовини, отже,
 тобто розчин 20% відсотковий.
тобто розчин 20% відсотковий.
2. Молярна частка, N, - відношення кількості розчиненої речовини n1 до суми кількості - розчиненої речовини n1 і розчинника n2
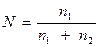
Приклад: Знайти молярну частку сульфату натрію в 15%-вом його розчині.
Розв’язок: У кожних 100 г розчину міститься 15г Nа2 S04 і 85г Н2О;
М(Nа2S04) = 142 г/моль; М(Н2О) = 18 г/моль;
n1 (Nа2S04) = 15/142= 0,105 моль; n2 (Н2О) 85/18 = 4,722 моль

У сучасній хімії розрізняють поняття «маса речовини» і «кількість речовини». Масу речовини виражають в одиницях маси: грам, кілограм, тонна. У системі СІ одиниця маси - кілограм. У системі СІ одиниця кількості речовини - моль. Моль - кількість речовини, що містить стільки ж структурних елементів (атомів, молекул, іонів та ін. часток), скільки міститься атомів у ізотопі вуглецю 12С масою 0,012 кг. Це число атомів дорівнює 6,02 х 1023 і називається числом Авогадро.
|
|
|
Необхідно розрізняти поняття: безрозмірну відносну молекулярну масу Мr і молярну масу М. Відносна молекулярна маса речовини (Мr) - величина, яка дорівнює відношенню маси молекули природного ізотопного складу речовини до 1/12 маси атома вуглецю - 12С.
Молярна маса (М) - величина, яка дорівнює відношенню маси речовини (m) до кількості речовини (n) -

Одиниці виміру молярної маси - г/ моль, кг/моль.
3. Молярна концентрація, СМ, показує кількість моль розчиненої речовини в 1 л розчину.

m - маса розчиненої речовини, г;
М - молярна маса, г/моль;
V - об’єм розчину, л.
Приклад: Визначити молярну концентрацію розчину, у 250 мл якого міститься 2,5 моль гідроксиду натрію.
Розв’язок: М (NаОН) = 40 г/моль
 моль/л
моль/л
4. Моляльна концентрація, Сm, показує кількість моль розчиненої речовини, що приходяться на 1000 г розчинника.
Сm 
m - маса розчиненої речовини, г.
М - молярна маса розчиненої речовини, г/моль;
G - маса розчинника, г.
Приклад: Визначити Сm водного розчину, у 200 г якого міститься 50,5 г КNОз
Розв’язок: М(КNОз) =101 г/моль. 
Сm  моль/кг
моль/кг
5. Нормальна концентрація, Сн, показує число г/еквівалентів розчиненої речовини, що містяться в 1 л розчину.
Сн 
Е - еквівалент розчиненої речовини, г.
Приклад: Визначити нормальну концентрацію розчину, що містить у 200 мл 1,96 г сульфатної кислоти.
Розв’язок: М(Н2S04) = 98 г/моль; Е(Н2S04) = 49 г
Сн 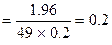 г-екв/л
г-екв/л
При розчиненні будь-якої речовини в розчиннику вирівнювання концентрації здійснюється внаслідок дифузії - самочинного руху розчиненої речовини з більш концентрованої частини розчину в менш концентровану, тобто деяка первинна впорядкованість в розподілі речовини (висока концентрація в одній частині системи і низька – в іншій) змінюється повною безладністю. При цьому ентропія системи зростає. Коли концентрація розчину у всьому об'ємі вирівняється – ентропія досягне максимального значення – дифузія припиниться.
|
|
|
3. Тривалий час вважали, що іони утворюються в розчині або в розплаві під дією електричного струму. Але потім було встановлено, що в розчинах або в розплавах, які проводять електричний струм, іони містяться незалежно від пропускання струму. Речовини, які в розчині (або розплаві) складаються повністю або частково з іонів, названо електролітами.
Як відбувається розпад електролітів на іони? У 1805 році литовський вчений Гротгус висунув гіпотезу про таке: частинки розчинених речовин складаються з позитивних і негативних частин і під дією електричного поля орієнтуються, розпадаючись ланцюжками, в яких позитивна частина кожної частинки направлена до катода, а негативна – до анода. Під дією струму найближчі до електродів частинки розряджаються і віддають відповідні іони електродам; частини їх, що залишаються, вступають в обмін з наступними частинками. Ці погляди були загальноприйнятими до 80-х років минулого століття.
У 1887 році італійський вчений С. Арреніус запропонував гіпотезу про електролітичну дисоціацію: молекули солей, кислот і основ при розчиненні їх у воді дисоціюють на іони. Недолік цієї гіпотези полягав у тому, що розчин електроліту розглядався як механічна суміш з молекул та іонів розчинника і молекул електроліту, тобто взаємодія між всіма цими частинками відсутня.
В подальшому розвитку гіпотези Арреніуса сприяли роботи І.А.Каблукова, Нернста, Джонса. Особливо роботи І.А. Каблукова: він стверджував, що іони можуть вступати у взаємодію з водою, утворюючи гідрати (змінного складу). І.В. Каблуков в своїй докторській дисертації писав: «На нашу думку, вода, розкладаючи частинки розчиненої речовини, входить з іонами в неміцні сполуки…».
Явище електролітичної дисоціації спостерігається не тільки у водних розчинах, але і в інших розчинниках, особливо, які мають високу діелектричну проникність. В цьому випадку здійснюється взаємодія, що приводить до утворення сольватів. Гідратація і сольватація іонів перешкоджають зворотному об’єднанню іонів в молекули.
|
|
|
Залежно від структури розчиненої речовини можливі два типи дисоціації:
а) за рахунок іон-дипольної взаємодії;
 |
б) за рахунок диполь-дипольної взаємодії.
За здатністю до дисоціації електроліти розділяють на сильні і слабкі. В основі розподілу α – ступінь електролітичної дисоціації.
а) сильні (α ~ 1): майже всі солі, кислоти, основи – KNO3, HClO4,
HCl, HBr, KOH, NaOH, Ba(OH)2, Ca(OH)2.
б) слабкі (α << 1): більшість органічних сполук – H2CO3, H2S,
НCN, H2SiO3, NH4OH.
 |
де n – число дисоційованих молекул; N – загальне число молекул у розчині. Наприклад: 0,1 н СН3СООН α = 0,013;
0,1 н НСN α = 10-4
Процес дисоціації слабкого електроліту є рівноважним і до нього застосовуються закони хімічної рівноваги.
Приклад: СН3СООН↔СН3СОО- + Н+

Константа рівноваги (Крівн.), що відповідає дисоціації слабкого електроліту називається константою дисоціації (Кдис.). Чим більша константа дисоціації Кдис., тим легше електроліт дисоціює. Якщо електроліт багатоосновний – дисоціація ступінчаста:
Н2СО3 ↔ Н+ + НСО3- 
НСО3- ↔ Н+ + СО32- 
Сумарно: Н2СО3 ↔ 2Н+ + СО32-
К = К1 . К2 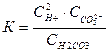
При ступінчастій дисоціації зберігається нерівність:
К1 > К2 > К3 ….
Взагалі, якщо позначити:
С – концентрація електроліту, що розпадається на 2 іони;
α – ступінь дисоціації;
С . α - концентрація кожного іона;
С (1- α) - концентрація недисоційованих молекул.
То рівняння Кдис. прийме вигляд:
 - Закон розбавлення Освальда (38)
- Закон розбавлення Освальда (38)
Згідно цього закону можна визначити α, якщо відома Кдис для різних концентрацій електроліту і навпаки. Для розчинів з α << 1 (тобто дисоціація дуже незначна) величиною α в знаменнику нехтують, тоді:
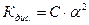 ,
, 
З отриманого рівняння видно, що ступінь дисоціації електроліту зростає при розбавленні розчину і навпаки.
4. Сильні електроліти. У водних розчинах молекули сильних електролітів практично повністю дисоційовані, тобто α → 1. Концентрація іонів велика, відстань між ними незначна, сили міжіонного притягування і відштовхування достатньо великі.
В 1923 році Дебай і Хюккель для характеристики стану іону в розчині сильного електроліту ввели поняття іонної атмосфери. Вважали, що кожен іон оточений з усіх боків іонами протилежного знаку, так званою іонною атмосферою. При наведені електричного поля іони і іонна атмосфера починають рухатися по різних напрямках, внаслідок чого спрямований рух іону даного виду гальмується, сила струму зменшиться. Чим більше концентрація розчину, тим сильніше виявляється гальмуюча дія іонної атмосфери на електропровідність розчину.
Визначене за електропровідністю або іншими методами, значення ступеня дисоціації, концентрації електроліту буде зменшеним і тому називається, відповідно, уявним ступенем дисоціації та активністю іону. Поняття активності іону було введено Люісом. Активність іону відрізняється від його концентрації на величину f, яку названо коефіцієнтом активності. Активність (а) іона – це та ефективна умовна концентрація його, відповідно якій він діє в хімічних реакціях.
a = f . Cm
а – активність;
f – коефіцієнт активності;
Сm – моляльна концентрація;
Для нескінченно розведених розчинів f = 1 і тому а ≈ Сm, для інших розчинів – менше одиниці і тому а < Cm.
Для опису властивостей розчинів сильних електролітів, широко використовують поняття іонної сили розчину, яку визначають за рівнянням:
 (39)
(39)
Сmi - молярна концентрація; ni – заряд іону.
Приклад: Розчин на 1000 г води містить 0,01 моль СаСl2 і 0,1 моль Na2SO4, визначити іонну силу розчину.
Розв¢язок:
I = ½ (0,01 . 22 + 0,02 . 12 + 0,2 . 12 + 0,1 . 22) = 0,33
Емпірично встановлено, а для сильно розбавлених розчинів може бути теоретичні обґрунтовано, правило іонної сили: коефіцієнт активності (f) даного електроліту в розчині залежить тільки від іонної сили розчину і при однаковому значенні її він зберігає постійне значення незалежно від виду інших електролітів, присутніх в розчині. У водних розчинах це правило застосовується до I = 0,02. Саме через іонну силу виявляється вплив природи іонів.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1422; Нарушение авторских прав?; Мы поможем в написании вашей работы!