
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При точных расчетах необходимо учитывать температурную зависимость теплоемкости в форме (25)
|
|
|
|
Тогда
Отсюда
 (12)
(12)
Cгруппировав переменные с одинаковыми индексами, получаем:
 (13)
(13)
Введем новую функцию состояния системы – энтальпию (H)
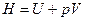 (14)
(14)
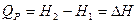 (15)
(15)
Таким образом, тепловой эффект изобарного процесса равен изменению энтальпии системы.
– адиабатический процесс
При адиабатическом процессе работа расширения совершается за счёт уменьшения внутренней энергии
 (16)
(16)
Тепловой эффект (теплота) химической реакции – это максимальное количество теплоты, выделившейся либо поглотившейся в ходе необратимой реакции, проводимой при p = const или V = const. Обычно тепловые эффекты приводят в расчете на один пробег реакции. Это означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
Тепловые эффекты, сопровождающие протекание химических реакций, являются предметом термохимии.
Основным законом термохимии является закон Гесса:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
В химической термодинамике с тандартное состояние – это состояние чистого вещества при давлении 1атм = 1·105 Па и заданной температуре.
Тепловые эффекты химических реакций, отнесённые к этим условиям, называются стандартными тепловыми эффектами ( или
или  ).
).
Стандартная энтальпия (теплота) образования соединения из простых веществ (Df H 0298, приводитcя в справочниках) – есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях.
|
|
|
Принято, что для простых веществ Df H 0298 = 0.
Рассмотрим химическую реакцию νАА + νВВ → νCС + νDD.
В термохимии для нахождения теплового эффекта реакции используют ряд следствий из закона Гесса:
Следствие 1. Тепловой эффект химической реакции равен разности сумм стандартных энтальпий образования продуктов реакции и исходных веществ, умноженных на соответствующие стехиометрические коэффициенты.
 (17)
(17)
Следствие 2. Тепловой эффект химической реакции равен разности сумм стандартных энтальпий сгорания исходных веществ и продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты.
 (18)
(18)
Стандартная энтальпия (теплота) сгорания – это теплота, выделяющаяся при сгорании при стандартных условиях в атмосфере кислорода 1 моля вещества до высших оксидов (в случае сгорания органических соединений – до высших оксидов и N2).
Связь между тепловыми эффектами Qp и QV для химических реакций выражается соотношением
Qp = QV + DnгазRT (19)
или  =
=  + DnгазRT, (20)
+ DnгазRT, (20)
где Dnгаз – изменение числа молей газообразных участников в результате одного пробега реакции ( ).
).
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов реакций при других температурах используют уравнение Кирхгофа:
 (21)
(21)
Если Т1 = 298 К, то
 (22)
(22)
Здесь ∆Ср - разность изобарных теплоёмкостей продуктов реакции и исходных веществ ( ).
).
Теплоемкость С р – это отношение количества сообщённой системе теплоты dQp к наблюдаемому при этом повышению температуры dT (при отсутствии химической реакции, переходов вещества из одного состояния в другое и W¢ = 0)
 (23)
(23)
Различают также изохорную теплоемкость СV.
Для идеальных газов справедливо уравнение Майера:
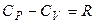 (24)
(24)
При расчете изменения теплового эффекта реакции в большом интервале температур необходимо учитывать зависимость теплоёмкости от температуры, которая выражается степенным рядом
|
|
|
С0р = а + bТ + сТ2
Или С0р = а+ bТ +  . (25)
. (25)
где коэффициенты a, b, c приведены в справочниках.
При вычислениях, в которых не нужна высокая точность, используются следующие приближения:
1) Считают, что DСр не зависит от температуры, и принимают величину DСр равной изменению средней для данного интервала теплоемкости (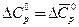 ). Тогда
). Тогда
 . (26)
. (26)
2) Считают, что DС0р = const = DСр,298 (значения Ср,298 для ряда веществ приведены в приложении). Тогда
 . (27)
. (27)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 570; Нарушение авторских прав?; Мы поможем в написании вашей работы!