
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Например, в случае газов
|
|
|
|
f = р·γ, (56)
где γ - коэффициент активности или фугитивности.
Константа, выраженная через равновесные активности (а i) называется термодинамической константой химического равновесия:
 (57)
(57)
Фазовые равновесия. Рассмотрим гетерогенную систему, в которой нет химических взаимодействий, а возможны лишь фазовые переходы. В такой системе при постоянной температуре и давлении существует определенное фазовое равновесии, которое характеризуется определенным числом фаз, компонентов и числом степеней термодинамической свободы системы.
Фазой называется совокупность частей системы, обладающих одинаковыми термодинамическими свойствами
Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне её. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними.
Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
В соответствии с правилом фаз Гиббса, число степеней свободы равновесной термодинамической системы (С) равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс число внешних факторов, влияющих на равновесие.
Для системы, на которую из внешних факторов влияют только температура и давление, можно записать:
С = К – Ф + 2 (58)
На практике чаще рассматривают влияние на систему только одного переменного внешнего параметра (постоянное давление, или постоянная температура). В этом случае
С = К – Ф + 1 (59)
Число степеней свободы характеризует вариантность системы: система может быть нонвариантной (С = 0), моновариантной (С = 1), бивариантной (С = 2) и т. д.
|
|
|
В системах, состоящих из нескольких фаз одного вещества, возможно протекание фазовых переходов (плавление, испарение, возгонка, переходы между различными кристаллическими модификациями).
Влияние давления на температуру фазового перехода описывает уравнение Клаузиуса – Клапейрона
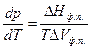 (60)
(60)
где DНф.п . – молярная теплота (энтальпия) фазового перехода.
D Vф.п = V2 - V1 – изменение молярного объема вещества при фазовом переходе.
Поскольку энтальпия плавления положительна, то знак производной 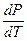 зависит от знака DVплавл. Для подавляющего большинства веществ DVплавл >0 и температура плавления растет с ростом давления. Однако существуют вещества (вода, висмут, галлий, сурьма, кремний), для которых DVплавл < 0, и их температура плавления понижается с повышением давления.
зависит от знака DVплавл. Для подавляющего большинства веществ DVплавл >0 и температура плавления растет с ростом давления. Однако существуют вещества (вода, висмут, галлий, сурьма, кремний), для которых DVплавл < 0, и их температура плавления понижается с повышением давления.
Для процесса плавления легко получить интегральную форму уравнения Клаузиуса-Клапейрона, позволяющую рассчитать температуру фазового перехода при любом давлении
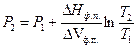 (61)
(61)
Для процессов возгонки (сублимации) и испарения используется другая дифференциальная форма уравнения Клаузиуса – Клапейрона
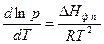 (62)
(62)
Так как и DHвозг , и DHисп больше нуля, то давление насыщенного пара над веществом всегда увеличивается при увеличении температуры.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 402; Нарушение авторских прав?; Мы поможем в написании вашей работы!