
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поэтому водородный электрод применяется как индикаторный при экспериментальном определении pH растворов
|
|
|
|
Поэтому
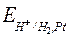 =
= 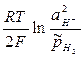 , (8)
, (8)
где 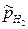 – относительное парциальное давление водорода.
– относительное парциальное давление водорода.
При 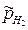 = 1 потенциал электрода определяется величиной pH раствора
= 1 потенциал электрода определяется величиной pH раствора
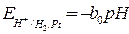 , (9)
, (9)
Потенциалы всех других электродов принято определять по отношению к потенциалу стандартного водородного электрода ( 
 =1 ). Такая условная шкала потенциалов называется водородной шкалой.
=1 ). Такая условная шкала потенциалов называется водородной шкалой.
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. По отношению к трудно растворимому соединению раствор должен быть насыщенным. Электроды An-/MA, M являются обратимыми по отношению к анионам, и уравнение потенциалобразующей электродной реакции имеет вид
MA + nе = M + An-
Этой реакции соответствует уравнение для расчета электродного потенциала (aMA = aM = 1)
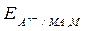 =
= 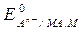 -
- 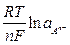 . (10)
. (10)
Отметим, что электрод второго рода формально можно рассматривать и как электрод первого рода, обратимый относительно катиона (активность катиона Mn+ в растворе определяется произведением растворимости соединения MA).
Вследствие устойчивости величины потенциалов электроды второго рода могут применяться как электроды сравнения при потенциометрических измерениях. Наиболее часто с этой целью используют каломельный (Cl- ½ Hg2Cl2 ,Hg) и хлорсеребряный Cl- ½ AgCl, Ag) электроды.
Окислительно-востановительные электроды, как правило, состоят из инертного вещества с электронной проводимостью (например, платины), погруженного в раствор, содержащий вещество с различной степенью окисления Ox и Red ( схема электрода Ox, Red ½ Pt).
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!