
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость реакции может быть выражена через изменение концентрации любого участника реакции
|
|
|
|
Приведенная реакция является необратимой двухстадийной, причем обе составляющие ее реакции являются необратимыми реакциями первого порядка.
Уравнение легко интегрируется
С учетом принципа независимости, основной постулат химической кинетики позволяет записать
После преобразований получим
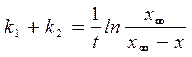 , (21)
, (21)
где 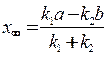 .
.
2) Параллельные реакции
Простейшая схема параллельной реакции, состоящей из двух одновременно протекающих реакций первого порядка
В  А
А  С.
С.
 (22)
(22)
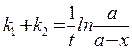 (23)
(23)
Очевидно, что в любой момент времени t отношение концентраций продуктов реакции будет величиной постоянной
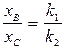 (24)
(24)

Рис.13. Зависимость концентраций реагента и продукта от времени для параллельных реакций первого порядка.
Совместное решение уравнений (23)-(24) позволит найти константы k1 и k2 раздельно.
3) Последовательные реакции
К последовательным относят реакции типа А  В
В 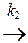 С.
С.
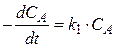 (25)
(25)
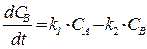 (26)
(26)
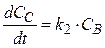 (27)
(27)
Кинетические кривые для рассматриваемого случая показаны на рис.14.
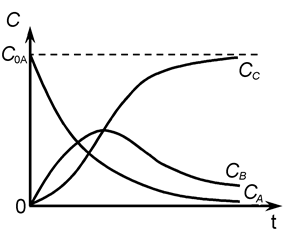
Рис.14. Зависимость концентраций реагента и продукта от времени для последовательных реакций.
Положение максимума на кривой «CB» (и точки перегиба на кривой «CC») определяются соотношением величин k 1 и k 2:
а) если k 1 >> k 2, промежуточный продукт B будет устойчив и может быть достигнута концентрация CB, соизмеримая с CA; продукт С образуется с малой скоростью.
б) если k 2 >> k 1, промежуточный продукт B - неустойчив, его концентрация CB - мала, но высока скорость образования продукта С.
Скорость всего процесса будет определяться лимитирующей стадией сложной реакции. В соответствии с принципом лимитирующей стадии скорость последовательной реакции определяется скоростью наиболее медленной стадии, суммарная скорость параллельных реакций определяется скоростью наиболее быстрой стадии.
|
|
|
Зависимость скорости реакции от температуры. В подавляющем большинстве случаев скорость реакции растет с увеличением температуры, что связано с увеличением константы скорости реакции.
Согласно эмпирическому правилу Вант-Гоффа, при повышении температуры на 10оС скорость реакции увеличивается в 2-4 раза. Для количественного описания наблюдаемой зависимости введен температурный коэффициент g
 или
или  (28)
(28)
Правило Вант-Гоффа справедливо лишь в области температур вблизи комнатной. Более точную зависимость дает уравнение Аррениуса
 (29)
(29)
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!