
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Таким образом, в процессе данной реакции теплота выделяется (экзотермический процесс)
При стандартных условиях на основании энтальпий образование участников реакций.
Решение. В соответствии со следствием из закона Гесса энтальпия реакции
 = 2
= 2 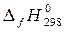 (C3H4O3, ж) + 2
(C3H4O3, ж) + 2 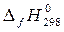 (H2O, ж) -
(H2O, ж) -
-  (С6Н12О6. тв) -
(С6Н12О6. тв) -  (O2, г)
(O2, г)
Энтальпия образования простых веществ 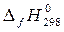 (O2, г) по определению равна нулю. По таблице термодинамических свойств веществ находим стандартные энтальпии образования остальных участников реакции
(O2, г) по определению равна нулю. По таблице термодинамических свойств веществ находим стандартные энтальпии образования остальных участников реакции
 (C3H4O, ж) = - 581,79 кДж∙моль-1
(C3H4O, ж) = - 581,79 кДж∙моль-1
 (H2O, ж) = - 285,83 кДж∙моль-1
(H2O, ж) = - 285,83 кДж∙моль-1
 (С6Н12О6, тв) = - 1250,0 кДж∙моль-1
(С6Н12О6, тв) = - 1250,0 кДж∙моль-1
После численной подстановки получим:
 = 2(- 581,79) + 2(- 285,83) + 1250,0 = - 485,24 кДж
= 2(- 581,79) + 2(- 285,83) + 1250,0 = - 485,24 кДж
Пример 2. Рассчитать энтальпию реакции синтеза аммиака
1/2 N2(г) + 3/2Н2(г) → NH3(г),
при температуре.1000 К, если энтальпия образования аммиака при стандартных условиях составляет (-45,94) кДж∙моль-1, а температурная зависимость теплоёмкости (Ср, Дж∙моль-1∙К-1) участников реакции выражается уравнениями:
Ср(NH3) = 29,80 + 25,48 10 -3 Т – 1,67 10 5 Т -2
Ср(N2) = 27,88 + 4,27 10 -3 Т
Ср(H2) = 27,28 + 33,26 10 -3 Т + 0,50 10 5 Т -2
Решение. Энтальпию реакции при 1000 К находим по уравнению Кирхгоффа
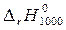 =
=  +
+ 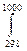
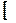 Ср(NH3) – 1/ 2 Ср(N2) – 3/2 Ср(H2)
Ср(NH3) – 1/ 2 Ср(N2) – 3/2 Ср(H2) 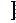 dT
dT
Энтальпия реакции при 298 К в данном случае равна стандартной энтальпии образования NH3, то есть
 =
=  (NH3, г) = - 45940 Дж
(NH3, г) = - 45940 Дж
При подстановке соответствующих выражений для теплоемкости NH3, N2 и H2 в уравнении Кирхгоффа получим:
 = - 45940 +
= - 45940 + 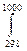 [(29,80 + 25,48∙10 -3 Т – 1,67∙10 5 Т -2) –
[(29,80 + 25,48∙10 -3 Т – 1,67∙10 5 Т -2) –
1/2 (27,88 + 4,27∙10 -3 Т) – 3/2(27,28 + 33,26∙10-3 Т + 0,50∙105 Т-2)] dT =
= - 45940 + 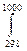 (-25,06 + 18,46∙10-3T – 2,42∙105T-2) dT = -45940 – 25,06(100 – 298) + ½ 18.46∙10-3(10002 – 2982) + 2.45∙105(1/1000 – 1/298) =
(-25,06 + 18,46∙10-3T – 2,42∙105T-2) dT = -45940 – 25,06(100 – 298) + ½ 18.46∙10-3(10002 – 2982) + 2.45∙105(1/1000 – 1/298) =
= -55689 Дж = -55,69 кДж.
|
|
Дата добавления: 2014-11-16; Просмотров: 560; Нарушение авторских прав?; Мы поможем в написании вашей работы!