
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В атоме по состояниям
|
|
|
|
Принцип Паули. Распределение электронов
Состояние электрона в атоме однозначно и определяется набором четырех квантовых чисел:
главного n (n = 1, 2, 3,...);
орбитального 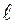 (
(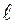 = 0,.1, 2,.., n-1);
= 0,.1, 2,.., n-1);
магнитного  (
( = -l…, -1, 0, +1,…, l),
= -l…, -1, 0, +1,…, l),
магнитного спинового m S (mS=+ 1/2, -1/2).
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, 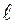 ,
,  и mS, т.е.
и mS, т.е.
Z(n, 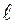 , mS,
, mS,  ) = 0 или 1,
) = 0 или 1,
где Z(n, 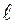 , mS,
, mS,  ) - число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n,
) - число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, 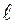 ,
,  и mS. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями, по крайней мере, одного квантового числа.
и mS. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями, по крайней мере, одного квантового числа.
Согласно формуле 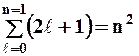 , данному n соответствует n2 различных состояний, отличающихся значениями
, данному n соответствует n2 различных состояний, отличающихся значениями 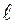 и
и  . Квантовое число mS может принимать лишь два значения (
. Квантовое число mS может принимать лишь два значения (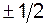 ). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным квантовым числом, равно
). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным квантовым числом, равно
 .
.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному 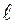 . Поскольку орбитальное квантовое число принимает значения от 0 до n-1, число подоболочек равно порядковому номеру n -оболочки.
. Поскольку орбитальное квантовое число принимает значения от 0 до n-1, число подоболочек равно порядковому номеру n -оболочки.
Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами. Максимальное число электронов в подоболочке с данным 1 равно 2(21 + 1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в таблице.
|
|
|
| Главное квантовое число | |||||
| Символы оболочки | К | L | M | N | O |
| Максимальное число электронов в оболочке | |||||
Орбитальное квантовое число 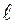
| 0 1 | 0 1 2 | 0 1 2 3 | 0 1 2 3 4 | |
| Символы под- Оболочки | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f | 5s 5p 5d 5f 5g |
| Максимальное число электронов в подоболочке | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 14 18 |
Принцип Паули, лежащий в основе систематики заполнения электронных состоянии в атомах, позволяет объяснить периодическую систему Менделеева, фундаментальный закон природы, являющийся основой современной химии, атомной и ядерной физики.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!