
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды. Водородный показатель
Физико-химические свойства растворов электролитов.
Примеры решения задач.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита.
Вычислить степень диссоциации 0,2 М раствора муравьиной кислоты HCOOH, если Кд=2,1∙10-4.
Решение: По закону разбавления α=√(Кд/См) = √(2,1∙10-4/0,2)=3,24∙10-2 или 3,24%.
Пример 2. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации Z iCI в 0,1М раствора соли, если раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 0ºС.
Решение: Моль сахара равен 342 г.
Росм=(mRT)/(M∙V)= (342∙0,19∙8,3144∙273)/ (342∙10-3) = 4,31∙105 Па.
М(ZiCI)=42 г∙моль-1. По осмотическому давлению определяем изотонический коэффициент раствора Z iCI
i=(Pосм∙V)/(nRT)=(4,31∙103∙10-3∙42,39)/(4,239∙8,3144∙273)= 1,19.
Кажущаяся степень диссоциации в 0,1 М Z iCI равна
α=(i-1)/(n-1)=(1,9-1)/(2-1)=0,9 или 90 %.
Пример 3. Вычисление степени диссоциации электролита по понижению давления пара растворителя над раствором.
Давление пара водного раствора NaNO3(ω=0,08) равно 2268,8 Па при 20 °С. Давление паров воды при этой температуре равно 2337,8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Решение. С помощью первого закона Рауля для электролитов вычисляем значение изотонического коэффициента для NaNO3:
i = (P0-P)∙(N+n)/P0∙n; M(NaNO3) = 85,00 г∙моль-1; n=8:85=0,094 моль; М(Н2О)=18,02 г∙моль-1;
i = (2337,8-2268,9) ∙ (0,094+5,911)/(2337,8∙0,094)=(0,69∙5,199)/219,75 = 1,63.
Кажущаяся степень диссоциации NaNO3 в этом растворе равна
α=(1,63-1)/(2-1) = 0,63 (или 63 %).
Пример 4. Вычисление изотонического коэффициента по повышению температуры кипения раствора.
Раствор, содержащий 8 г NaOH в 1000 г Н2О, кипит при 100,184°С.
Определите изотонический коэффициент (для воды Е =-0,516°С).
Решение. Второй закон Рауля для растворов электролитов выражается уравнением ∆t0кип=ι∙ (Кэ∙100∙m)/(mр-ля∙М(р.в)). Тогда
ι = (∆t0кип∙mр-ля*М(р.в))/(Кэ∙m∙1000)= (0,184∙1000∙40)/(0,516∙1000∙8)=1,78.
Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации: 2Н2О↔Н3О++ОН- или в упрощенной форме Н2О↔Н++ОН-;
Константа диссоциации воды весьма мала при 25°С
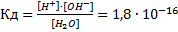
Принимая поэтому концентрацию воды [Н2О] величиной практически постоянной, можно записать К∙ [Н2О]=[Н+] ∙ [ОН-] = 1,8∙10-16[Н2О]. Но концентрация воды равна 1000/18=55,56 моль∙л-1, отсюда получаем
[Н+]∙[ОН-] = =1,8∙10-16∙55,56=1∙10-14=Кв.
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды Кв. Ионное произведение воды
есть величина постоянная при постоянной температуре. В чистой воде и нейтральных растворах[Н+]=[ОН-]=√10-14=10-7 моль∙л-1.
Математически более удобной характеристикой среды является водородный показатель рН, равный десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: рН = -lg[Н+].
Тогда рН различных растворов будут иметь следующие значения:
кислый рН <7;
нейтральный рН = 7;
щелочной рН >7.
Аналогично, отрицательный десятичный логарифм концентрации гидроксо-ионов называется гидроксильным показателем и обозначается рОН. Следовательно,
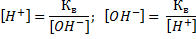
рН + рОН = 14.
Пример 1. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора гидроксида натрия, содержащегося в растворе в концентрации 4,2∙10-3 моль∙л-1.
Решение. Концентрация ОН- ионов в растворе NaOH равна
[0Н-]=4,2∙10-3моль∙л -1. Исходя из ионного произведения воды Кв, находим концентрацию ионов водорода: [Н+]=КВ/[ОН-]=10-14/4,2∙10-3=0,24∙10-11. Водородный показатель раствора NaOH равен: рН= -lg([Н+])=-lg(0,24∙10-11)=11,62.
Пример 2. Определение концентрации ионов Н+ и ОН- в растворах сильных кислот и оснований.
Определите концентрацию ионов водорода и рН в 0,01 М раствора соляной кислоты.
Решение. Соляная кислота – сильный электролит, в растворе полностью диссоциирует на ионы: НС1  Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Пример 3. Вычисление рН сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель раствора НNO3, если его молярная концентрация равна 0,178 моль∙л-1.
Решение. При значительной концентрации сильного электролита его активная концентрация существенно отличается от истинной. Поэтому в таких случаях нужно вводить поправку на активность электролита. Определяем ионную силу раствора НNO3: J= 1/2∙ (0,176∙I2 + 0,178∙I2) = 0,356/2 = 0,178.
Далее по вычисленной ионной силе находим коэффициент активности иона [Н+]= f(Н+)=0.838. Тогда активность ионов [Н+], а (Н+) =0,83∙0,178=0,148. Водородный показатель раствора НNO3 равен: рН = -lg а(Н+) = -lg 0,148=0,83.
Пример 4. Определение концентрации ионов Н+ и ОН- в растворах слабых кислот и оснований.
Концентрации [Н+] и [ОН-] ионов в растворах слабой кислоты и слабого основания могут быть вычислены, если известны их константы диссоциации. В общем виде формула для вычисления концентрации [Н+] в растворе слабой кислоты: 
Концентрация ионов [Н+]и [ОН-] в растворе слабого основания может быть вычислена по формуле:  ; [Н+]= Кв/[ОН-];
; [Н+]= Кв/[ОН-];
 .
.
Определите концентрацию[Н+], [ОН-], рН, рОН, в 0,0М раствора муравьиной кислоты, если Кд(HCOOH)=2,1∙10-4
Решение:
[Н+]=√2,1∙10-4∙3∙10-2 = √6,3∙10-6= 2,5∙10-3 моль∙л-1;
рН= -lg 2,5∙10-3=3-lg 2,5 = 3-0,4= 2,6;
[ОН-]= Кв/[Н+]= 10-14/(2,5∙10-3)=4∙10-12 моль∙л-1;
рОН= 14-рН=14-2,6 = 11,4.
|
|
Дата добавления: 2014-11-16; Просмотров: 845; Нарушение авторских прав?; Мы поможем в написании вашей работы!