
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 11 страница
Образование мицелл характерно для водных растворов моющих веществ (например, мыл — щелочных солей высших жирных кислот) и некоторых органических красителей с большими молекулами. В других средах, например в этиловом спирте, эти вещества растворяются с образованием молекулярных растворов.
III тип — молекулярные коллоиды. Их называют также обратимыми или лиофильными (от греч. «филио»— люблю) коллоидами. К ним относятся природные и синтетические высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов *. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений — это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов. Растворы высокомолекулярных соединений могут быть приготовлены также с высоким содержанием по массе — до десяти и более процентов. Однако молярная концентрация таких растворов мала из-за большой молекулярной массы растворенного вещества. Так, 10 %-ный раствор вещества с молекулярной массой 100 ООО представляет собой лишь примерно 0,0011 М раствор.
| * О природных и синтетических высокомолекулярных соединениях и полил Мерах см, § 177, |
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем. Неполярные макромолекулы растворяются в углеводородах (например, каучуки — в бензоле), а полярные макромолекулы — в полярных растворителях (например, некоторые белки — в воде и водных растворах солей). Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор. Название лиофильиые коллоиды возникло из предположения (как оказалось — ошибочного), что сильное взаимодействие со средой обусловливает их отличие от лиофобных коллоидов.
Растворение макромолекулярных коллоидов проходит через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа. Прн набухании молекулы растворителя проникают в твердый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличении объема полимера. Набухание может быть неограниченным, когда конечным его результатом является переход полимера в раствор, и ограниченным, если набухание не доходит до растворения полимера. Ограниченно набухают обычно полимеры с особой, «трехмерной» структурой, отличающейся тем, что атомы всего вещества соединены валентными связями. Химическая модификация полимеров путем «сшивания» их макромолекул с целью уменьшения набухания полимера является важной стадией в производстве многих материалов (дубление сыромятной кожи, вулканизация каучука при превращении его в резину).
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и часто понижение температуры приводят к застудневанию, т. е. превращению сильно вязкого, но текучего раствора в сохраняющий форму твердообразный студень. Растворы полимеров с сильно вытянутыми макромолекулами застудневают прн небольшой концентрации раствора. Так, желатин и агар-агар образуют студии и гели в 0,2—0,1 % растворах. Высушенные студни способ-, ны вновь набухать (существенное отличие от гелей).
Застудневание является важной стадией получения волокнистых материалов из растворов полимеров. Свойства растворов высокомолекулярных соединений с повышением их концентрации все больше и больше отличаются от свойств растворов низкомолекуляриых соединений. Это происходит в результате взаимодействия друг с другом отдельных макромолекул, приводящего к образованию надмолекулярных структур, оказывающих большое влияние иа качества изделий (волокон, пластмасс) из полимеров.
Высокомолекулярные соединения, как и любые другие вещества, при подходящих условиях могут быть получены в высокодисперсном — коллоидном состоянии. Такие дисперсии полимеров в нерастворяющих их жидкостях, большей частью в воде, называют латекса ми. Частицы дисперсной фазы ла-тексов имеют близкую к сферической форму и размеры порядка 10—100 им.
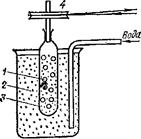
Термин «коллоиды», что означает «клееподобные» (от греч. «колла» — клей, «еидос» — вид), возник в 1861 г., когда шотландский химик Томас Грэм для разделения веществ применил диализ (рис. 91). Метод диализа основан на неодинаковой способности компонентов растворов к диффузии через тонкие пленки —■
|
Рис. 91. Схема диализа:
/ — внутренний диализнруемый раствор; 2 — наружная жидкость; 3 — диализационная мембрана (через ее поры проходят только низкомолекулярные вещества); 4 — шкив для вращения мембраны с внутренним раствором.
мембраны (из целлофана, пергамента, нитроцеллюлозы, ацетилцеллюлозы). Этот метод широко применяют для очистки коллоидных растворов и растворов высокомолекулярных соединений. Вещества, не проникающие через мембраны при диализе, Грэм назвал коллоидами, а вещества, способные к диализу,— кристаллоидами, так как при выпаривании их растворов образовывались кристаллические осадки.
Деление веществ на кристаллоиды и коллоиды оказалось ошибочным. П. П. Веймарн, доцент Петербургского горного института, получил ряд типичных «кристаллоидов» в коллоидном состоянии, тем самым доказав (1906 г.), что любое вещество при подходящих условиях может быть получено в коллоидном состоянии.
В 30—40-х годах XX века была выяснена химическая природа первичных частиц обратимых (лиофильных) коллоидов, оказавшихся макромолекулами. В связи с этим от коллоидной химии отделилась новая химическая дисциплина — физическая химия высокомолекулярных соединений. Однако в силу исторических причин, общности молекулярно-кинетических свойств лиофильных и лиофобных коллоидов, частого образования гетерогенных структур в молекулярных коллоидах, а также существования многочисленных композиций из высокомолекулярных соединений и высокоднсперсных систем (например, резины, многие лакокрасочные материалы, стеклопластики, пено- и поропласты) предмет коллоидной химии трактуют более расширенно, чем сказано в § 106, а именно, как физическую химию гетерогенного дисперсного состояния вещества, межфазовых поверхностей и высокомолекулярных соединений.
108. Дисперсионный анализ. Оптические и молекулярно-кине-тические свойства дисперсных систем. Дисперсионный анализ состоит в определении размеров частиц и удельной поверхности дисперсной фазы, а в случае полидисперсных систем также в установлении распределения диспергированного вещества по фракциям различного размера.
Простейшим методом дисперсионного анализа является ситовой анализ, состоящий в рассеве исследуемого образца через сита с определенными размерами отверстий. Определив массу каждой из фракций, находят распределение исследуемого образца по фракциям разного размера. Ситовой анализ позволяет анализировать порошки до 60 мкм в поперечнике. Методы дисперсионного анализа более высокодисперсных систем основываются на их оптических и молекулярно-кинетических свойствах.
Взаимодействие света с веществом зависит от соотношения длины волны света и размеров частиц, на которые падает световой поток. Это взаимодействие происходит по законам геометрической оптики (отражение, преломление), если размеры объекта больше
|
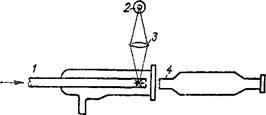
Рис. 92. Схема лоточного ультра-Микроскопа Б. В. Дерягина и Г. Я. Власенко:
1 — кювета; 2 — hci очник света; 5 — линза; 4 — тубус микроскопа.
длины волны света. Если размеры частиц меньше половины длины волны света, то происходит рассеивание света в результате его дифракции. Область видимого света характеризуется длиной волн от 760 до 400 нм. Поэтому в молекулярных и коллоидных системах видимый свет рассеивается, а в проходящем свете эти растворы прозрачны. Наибольшей интенсивности рассеивание света достигает в коллоидных системах, для которых светорассеяние является характерной качественной особенностью. Обнаружение в растворе пути луча источника света при рассматривании раствора перпендикулярно к направлению этого луча позволяет отличить коллоидный раствор от истинного. На этом же принципе основано устройство ультрамикроскопа, в котором наблюдения проводят, в отличие от обычного микроскопа, перпендикулярно направлению проходящего через объект света. Схема поточного ультрамикроскопа Б. В. Дерягина и Г. Я. Власенко приведена на рис. 92. С помощью этого прибора определяют концентрацию дисперсных частиц в аэрозолях и коллоидных растворах.
Форму коллоидных частиц, вирусов, многих макромолекул, включая молекулы более крупных белков, впервые оказалось возможным увидеть на флуоресцирующем экране и сфотографировать с помощью электронного микроскопа, изобретенного в конце 30-х годов XX века. Длина волны потока электронов при достаточной ускоряющей разности потенциалов имеет порядок Ю-10 м, что меньше размеров коллоидных частиц. Поэтому взаимодействие потока электронов с коллоидными частицами происходит по. законам геометрической оптики *.
На рис. 93 показаны пределы применимости оптических методов исследования дисперсных систем. Коллоидные частицы проходят через бумажные фильтры, но задерживаются ультрафильтрами (мембранными фильтрами), представляющими собой гели полимеров в виде пленок. Зная радиус пор ультрафильтров, можно оценить размер коллоидных частиц.
Молекулярно-кинетическими называют те свойства, которые связаны с хаотическим тепловым движением частиц, образующих те или иные системы. Различия в молекулярно-кине-тическом поведении молекулярно-, коллоидно- и микроскопически-дисперсных систем зависят от размеров частиц, образующих эти системы, и носят количественный характер.
| * Максимальное увеличение электронного микроскопа достигает 600 000 раз, а светового только 1500 раз, |
К молекулярно-кинетическим свойствам дисперсных систем относятся броуновское движение, диффузия и седиментация.
Броуновским движением называется беспорядочное, хаотичное — подобно рою комаров, пляшущих в солнечном луче,— движение коллоидно- и микроскопически-дисперсных частиц. Это явление получило название по имени.английского ботаника Р. Броуна, впервые в 1827 г. обнаружившего под микроскопом непрерывные колебательные движения пыльцы растений в ее взвеси в воде.
А. Эйнштейн в 1905 г. и независимо от него польский физик М. Смолуховский в 1906 г. развили молекулярно-статнстическую теорию броуновского движения, доказав, что оно является видимым под микроскопом отражением невидимого теплового, хаотичного движения молекул дисперсионной среды. Интенсивность броуновского движения тем больше, чем менее скомпенсированы удары, которые получает одновременно частица со стороны молекул среды; она возрастает с повышением температуры, уменьшением размеров частиц и вязкости среды. Для частиц крупнее 1—3 мкм броуновское движение прекращается. В конце первого десятилетия XX века Жан Перрен, исследуя броуновское движение сферических частиц, вычислил по уравнению Эйнштейна —■ Смолуховского число Авогадро, оказавшееся в хорошем согласии с его значениями, найденными другими методами. Тем самым была доказана справедливость молекулярно-статистической теории броуновского движения и подтверждена реальность существования молекул дисперсионной среды, находящихся в непрерывном тепловом хаотическом движении. В настоящее время наблюдения за броуновским движением используют для определения размеров дисперсных частиц.
Скорость диффузии при постоянных температуре и вязкости среды зависит от величины и формы частиц. Медленность диффузии является признаком, отличающим коллоидные системы от истинных растворов низкомолекулярных веществ.
| Ультрамикроскоп |
| Световой 2 микроскоп |
| Липа ■ 1 |
| Электронный микроскоп |
| Грф- |
| Молеку лярные |
| Тонко ducnepCHbie |
| Кошидньк |
| Тонкая взвеси |
| Крупная взвесь |
Седиментацией называют свободное оседание частиц в вязкой среде под действием гравитационного поля. Скорость оседания прямо пропорциональна ускорению гравитационного поля Земли (g), разности плотностей частиц и окружающей среды, квадрату
_ Бактерии
 Поры коллодийных мемдран
Поры коллодийных мемдран
10"
ю
Рис. 93. Границы размеров частиц дисперсных систем и применения оптических методов определения дисперсности:
| Пор |
/ — глаз; 2 — З'льтрафнолетовый мик-106нм(мт) роскоп. Для сравнения показан размер
пор бумажных фильтров (3) ультрафильтров (4),
!09. Сорбция и сорбционные процессы. Молекулярная адсорбция
| Растворите/lb г ООО ® ® ® ® ® ® ® |
|
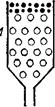
Рис. 94. Схема гель-хроматографии:
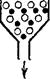
|
/ — на колонку с гелем (сферические светлые частицы) нанесен исследуемый раствор; 2 — после промывания колонки растворителем.
радиуса оседающих сферических частиц и обратно пропорциональна вязкости среды (закон Стокса, 1880 г.).
Седиментируют только достаточно крупные частицы. Так, частицы кварца размером 5 мкм оседают в воде за час на 3 см. Седиментации частиц размером 1 мкм и
менее препятствует броуновское движение. Поэтому истинные и коллоидные растворы, включая растворы высокомолекулярных соединений, седиментационно устойчивы, а сус-пен-зии — неустойчивы.
Предоставив суспензии осаждаться под действием силы тяжести, через определенные промежутки времени определяют массу частиц, накопившихся на чашечке, погруженной в суспензию на определенную глубину. Так можно установить распределение частиц по фракциям разного размера. Такой метод дисперсионного анализа суспензий получил название седиментационного анализа. Его широко применяют при изучении дисперсных систем с размерами частиц от 100 до 1 мкм, в частности почв и грунтов.
Применение ультрацентрифуг, в которых ускорение в миллион раз превосходит ускорение силы тяжести, дало возможность изучить седиментацию белков и других высокомолекулярных соединений, а также вирусов.
За последние годы широкое применение для разделения высокомолекулярных веществ и определения их молекулярной массы нашел предложенный Л. Поратом и П. Флодииом (Швеция) метод гель-фильтрации (гель-хроматографии). Гель-хроматография состоит в фильтровании исследуемого раствора через колонки, заполненные зернами набухающего трехмерного полимера (се-фадекса). Набухшие зерна сефадекса представляют собой своеобразные «клетки», внутрь которых могут проникнуть путем диффузии только молекулы (ионы) подходящего размера. Более крупные молекулы проходят с фильтрационным потоком мимо зерен сефадекса (рис. 94). Набор различных марок сефадексов с возрастающим размером «клеток» позволяет отделять низкомолекулярные вещества от высокомолекулярных, разделять макромолекулы, изучать образование ассоциатов в макромолекулярных растворах.
109. Сорбция и сорбционные процессы. Молекулярная адсорбция. Сорбцией (от латинского «sorbeo» — поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорб-тива) другим (сорбентом), независимо от механизма поглощения. В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию и капиллярную конденсацию.
Адсорбцией называют изменение концентрации вещества иа границе раздела фаз. Адсорбция происходит на любых межфа-еовых поверхностях, и адсорбироваться могут любые вещества. Адсорбционное равновесие, т. е. равновесное распределение вещества между пограничным слоем и граничащими фазами, является динамическим равновесием и быстро устанавливается. Адсорбция Уменьшается с повышением температуры.
В ряде случаев поглощение одного вещества другим не ограничивается поверхностным слоем, а происходит во всем объеме сорбента. Такое поглощение называют абсорбци-ей. Примером процесса абсорбции является растворение газов в жидкостях. Поглощение одного вещества другим, сопровождающееся химическими реакциями, называют хемосорбцией. Так, поглощение аммиака или хлороводорода водой, поглощение влаги и кислорода металлами с образованием оксидов и гидроксидов, поглощение диоксида углерода оксидом кальция — примеры хемосорб-ционных процессов. Капиллярная конденсация состоит в ожижении паров в микропористых сорбентах. Она происходит вследствие того, что давление паров над вогнутым мениском жидкости в смачиваемых ею узких капиллярах меньше, чем давление насыщенного пара над плоской поверхностью жидкости при той же температуре.
Таким образом, сорбционные процессы различны по их механизму. Однако любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твердыми.
Как указывалось в § 106, все самопроизвольные процессы на границах раздела фаз происходят в направлении уменьшения свободной поверхностной энергии. Следовательно, положительная адсорбция, приводящая к повышению концентрации вещества в пограничном слое, возможна только в том случае, если при этом уменьшается величина поверхностного натяжения.
|
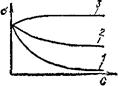
Рассмотрим взаимосвязь поверхностного натяжения растворов с адсорбцией на границе раздела жидкость|газ. Поверхностное натяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Зависимость поверхностного натяжения растворов при постоянной температуре от концентрации растворенного вещества называют изотермой поверхностного натяжения. Растворенные вещества или понижают поверхностное натяжение растворителя, и в таком случае их называют поверхностно-активными веществами (ПАВ), или повышают поверхностное натяжение (поверх ност-но-инактивные вещества), или не влияют на величину поверхностного натяжения растворителя (рис. 95). В водных растворах поверхностно-активны полярные органические соединения (спирты, кислоты, амины, фенолы). Поверхностно-инактивно большинство сильных электролитов.
Поверхностно-активные вещества делятся на две большие подгруппы: 1) истинно растворимые в воде и 2) мицеллярные коллои-
Рис. 95. Изотермы поверхностного натяжения рзстворов (0—поверхностное натяжение, С — концентрация раствора):
2 — растворы поверхяостно-актявных веществ (ПАВ) с большей (1) и меньшей (2) поверхностной активностью; 3 раствор поверхностно-активного вещества,
109. Сорбция и сорбционные процессы. Молекулярная адсорбция
|
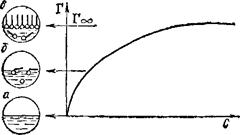
Рис. 96. Изотерма поверхностного избытка (Г) в растворах поверхностно-активного вещества.
Структура поверхностного слоя: а — чистый растворитель; б — ненасыщенный моиомолекулярный слой ПАВ; в — насыщенный мономолекулярный слой ПАВ.
ды. ПАВ первой подгруппы представляют собой ди-фильные молекулы с короткими углеводородными ра дикалами, а ПАВ второй подгруппы—дифильные молекулы с длинными углеводородными радикалами,.малорастворимые в воде.
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объема раствора называют поверхностным избытком этого вещества и обозначают греческой буквой Г («гамма»). ПАВ положительно адсорбируются в поверхностном слое и, следовательно, для них Г > О, поскольку это приводит к уменьшению поверхностного натяжения. Напротив, по-верхностно-инактивные вещества адсорбируются отрицательно, т. е. их концентрация в поверхностном слое меньше, чем в объеме раствора (Г<0). При этом поверхностное натяжение несколько возрастает в результате того, что в растворах сильных электролитов поверхностные молекулы воды втягиваются внутрь раствора с большей силой, чем в чистой воде.
Пример изотермы адсорбции для поверхностно-активного вещества показан на рис. 96. Как видно, с увеличением концентрации раствора Г достигает предельного значения (Гоо), когда весь поверхностный слой занят молекулами ПАВ, вытеснившими молекулы растворителя. В таких насыщенных мономолекулярных поверхностных слоях молекулы ПАВ правильно ориентированы — своей полярной группой к полярной фазе (например, воде), а неполярным углеводородным радикалом — к неполярной фазе (например, воздуху), образуя подобие частокола.
Аналогично изменяется пограничное натяжение и происходит адсорбция третьего компонента на границе двух несмешивающихся жидкостей.
Адсорбция газов и паров на поверхности твердых тел также происходит в результате уменьшения свободной поверхностной энергии. Ввиду трудности измерения поверхностного натяжения твердых тел, об адсорбции на них судят, непосредственно определяя количество адсорбированного вещества. Последнее тем больше, чем больше поверхность адсорбента. Поэтому для осуществления адсорбционных процессов весьма важно создание высокопористых адсорбентов с развитой внутренней поверхностью, которую характеризуют удельной поверхностью, т. е. поверхностью, приходящейся на 1 г сорбента. Важнейшими пористыми сорбентами являются активный уголь и силикагель. Поглощающая
способность угля подмечена еще в XVIII веке. Однако лишь в 1915 г. Н. Д. Зелинский* разработал способ получения активных углей, предложив их в качестве универсальных поглотителей отравляющих веществ, и совместно с Э. Л. Кумантом сконструировал угольный противогаз с резиновой маской. Один из первых способов активирования древесного угля состоял в обработке его перегретым паром для удаления смолистых веществ, образующихся при сухой перегонке древесины и заполняющих поры в обычном угле. Современные методы получения и исследования активных углей в нашей стране разработаны М. М. Дубининым **. Удельная поверхность активных углей достигает 1000 м2 на грамм. Активный уголь является гидрофобным адсорбентом, плохо поглощает пары воды и очень хорошо — углеводороды.
Для поглощения паров воды широко применяют гидрофильный адсорбент, представляющий собой аэрогель обезвоженной кремниевой кислоты и получивший название с ил и к а геля. Промышленность изготовляет ряд марок силикагеля с различным размером и распределением пор.
В отличие от поверхности жидкостей, не все точки поверхностей твердых тел равноценны в отношении их адсорбционной способности. При малых концентрациях газов адсорбция-происходит мо-, номолекулярно по наиболее активным участкам адсорбента — его «активным центрам», представляющим собой отдельные атомы или группы атомов поверхности, силовое поле которых наименее насы-. щено. При адсорбции газов, находящихся при температурах ниже их критической температуры, мономолекулярная адсорбция с увеличением давления может переходить в полимолекулярную.
Повышение температуры и понижение давления приводят к десорбции газов и паров. Вследствие этого сорбционно-десорбцнон-ные методы широко применяют в промышленности для извлечения различных веществ из воздушной среды, а также для разделения газов и паров.
| * Николай Дмитриевич Зелинский (1861—1953), академик, Герой Социалистического Труда, основатель крупной школы химиков-органиков. Ему принадлежат классические работы в области органического катализа, а также по химии нефти и получению из нее многих ценных продуктов. ** Михаил Михайлович Дубинин (род. 1901 г.) — академик, лауреат Государственных премий, глава крупной научной школы в области сорбции. Ёнес большой вклад в разработку современных представлений о механизме сорбции газов и паров, а также методов получения и исследования сорбентов* |
При адсорбции растворенных веществ из растворов на твердых адсорбентах всегда, в той или иной степени, происходит также адсорбция растворителей. Поэтому адсорбция из растворов носит конкурентный характер между поглощением растворенных веществ и растворителя. Адсорбироваться могут как растворенные неэлектролиты, так и электролиты. В связи с этим различают молекулярную и ионную адсорбцию из растворов.
С целью уменьшения адсорбции растворителя при молекулярной сорбции из водных растворов обычно применяют гидрофобный адсорбент — активный уголь, а при сорбции из неполярных растворителей (углеводородов) гидрофильный адсорбент — силикагель. Адсорбция протекает по активным центрам адсорбента, часто мо-номолекулярно и высокоизбирательно. Изотермы молекулярной адсорбции из растворов, так же как газов и паров, имеют вид кривой, приведенной на рис. 96. Десорбцию, осуществляемую с помощью жидкостей, обычно называют элюцией, а жидкости или растворы, применяемые для этих целей, элюентами.
Сорбция может происходить в статических или в динамических условиях» Сорбцию называют статической, когда поглощаемое вещество (сорбтив), находящееся в газообразной или жидкой фазе, приведено в контакт с неподвижным сорбентом или перемешивается с ним. Статическую активность сорбента характеризуют количеством поглощенного вещества на единицу массы сорбента в определенных условиях.
Динамической сорбцию называют в том случае, когда поглощаемое вещество находится в подвижной жидкой или газообразной фазе, которая фильтруется через слой сорбента. Динамическую активность адсорбента характеризуют временем от начала пропускания адсорбтива до его проскока, т. е, до появления его за слоем адсорбента (Н. А. Шилов, 1917 г.). В промышленности сорбционно-десорбционные процессы, как правило, осуществляют в динамических условиях, так как это обеспечивает непрерывность технологических процессов и возможность их автоматизации.
НО. Ионообменная адсорбция. При адсорбции электролитов преимущественно адсорбируются или катионы, или анионы, которые заменяются на эквивалентное количество ионов того же знака из адсорбента. Раствор остается при этом электронейтральным. Таким образом, адсорбция электролитов происходит путем эквивалентного обмена ионов одинакового знака, а потому получила название ионообменной адсорбции. Ионообменный механизм адсорбции электролитов первоначально был подмечен агрономами и почвоведами при вытеснении одних ионов почвенных электролитов другими. К. К. Гедройц* доказал (1918 г.) эквивалентность обмена катионов в почвах и создал учение о почвенном поглощающем комплексе (высокодисперсной органоминеральной части почвы), обусловливающем способность почв удерживать необходимые растениям растворимые соли в доступной для корневого питания форме.
| * Константин Каэтанович Гедройц (1872—1932) — академид, лауреат Ленинской премии, крупнейший почвовед-агрохимик. Основоположник учения о почвенном поглощающем комплексе и его роли В плодородии почв^ автор многих методов химического анализа почв. |
Неорганические и органические материалы, способные к обмену ионов, получили название ионитов. Их делят на катиониты (для обмена катионов) и аниониты (для обмена анионов). Разнообразные синтетические ионообменные материалы химической промышленностью выпускаются в виде зернистых порошков, волокон и мембран.
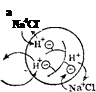
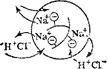
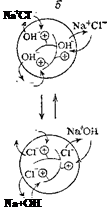 Рис. 97. Схема ионного обмена в зернах катионита (а) и анионита (б).'
Рис. 97. Схема ионного обмена в зернах катионита (а) и анионита (б).'
| Ka+Cl |
| NaTl |
Потенцналопределяющие — иоко-генпые гр\ппы, химически связанные с каркасом понита: соответственно Э и Q. Катионит в Н + -форм^, аиионит в ОН'-форые; Н+ и ОН — ноны, которые в растворе NaCl обмениваются, соответственно, на ионы Na+ и Cl".
|
Органические и неорганические иониты нерастворимы в воде. Они представляют собой трехмерный каркас, в который включены несущие заряд группы атомов, называемые потенциалопределяю-щими ионами. Ионы противоположного знака называют противо-ионами. Они связаны с потенциалопределяющими ионами каркаса электростатическими силами, а потому способны к обмену на другие ионы. Так, структуру стекла составляет трехмерная сетка кремнекислородных (силикатных) ионов. В пустотах этой трехмерной кремнекислородной решетки находятся катионы щелочных или щелочноземельных металлов, удерживаемые электростатическими силами и способные к обмену на другие катионы (в частности, на ионы водорода).
|
|
Дата добавления: 2014-11-16; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!