
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 12 страница
 |
| У0 —S—СГ V) |
В органических ионитах трехмерный каркас образован сеткой из углеродных атомов, с которыми ковалентно связаны, например, сульфо-, карбокси- или триметиламмоний-группы:
СН3
:о
| •О" |
-2;+-СН3
I
СН3
Рис. 97 иллюстрирует обмен катионов на Н+-форме катионита и обмен анионов на ОН~-форме анионита.
| Rx~xH+ + xNaCl катконит раствор |
Ионный обмен является обратимым процессом. Катионит как поливалентный электролит с валентностью х запишем схематично как R*~. Тогда после внесения Н+-формы катионита в раствор электролита, например, NaCl, установится равновесие:
R*~ (х - у) H+yNa+ + (х - у) NaCl + jrHCl ^=fc
катпоннт раствор
R*-xNa++хНС1 кагионит раствор
Максимальное количество ионов, которое поглощается обменным путем 1 г; ионита, называют емкостью поглощения,
111. Хроматография
или обменной емкостью *. Она достигает 6—10 мэкв/г. Ионообменное равновесие определяется природой ионита, гидратацией обменивающихся ионов, их концентрацией в фазе ионита и в растворе. Обмен разновалептных ионов зависит также от величины их заряда. Большой вклад в разработку теории и практики ионного обмена внес Б. П. Никольский **.
Иоииты широко используют для уменьшения жесткости воды и ее обессо-ливапия (см. § 212), для выделения и разделения разнообразных неорганических п органических ионов. Ионный обмен используют в кожевенной, гидролизной, фармацевтической промышленности для очистки растворов, а также для удаления солей из сахарных сиропов, молока, вин. С помощью ионитов улавливают ионы ценных элементов из природных растворов и отработанных вод различных производств. Промышленное производство многих продуктов жизнедеятельности микроорганизмов (антибиотиков, аминокислот) оказалось возможным или было значительно удешевлено благодаря использованию ионитов. Применение ионного обмена позволило усовершенствовать методы качественного и количественного анализа многих неорганических и органических веществ.
|
|
|
К веществам, обладающим ионообменными свойствами, принадлежат некоторые марки стекол. Их структуру составляет силикатный каркас и электростатически связанные с ним катионы, способные к обмену на ионы водорода раствора. Из таких стекол изготовляют стеклянные электроды, обладающие свойствами водородного электрода (см. стр. 272). Стеклянные электроды применяют для определения рН растворов в условиях, когда пользование водородным электродом затруднительно или невозможно (например, в присутствии сильных окислителей). Разработаны также стекла, электродный потенциал которых определяется концентрацией ионов металлов, — например, иона натрия.
111. Хроматография. Мысль о том, что адсорбция в динамических условиях улучшит разделение сложных смесей, впервые возникла у М. С. Цвета. Исходя из этой идеи, он в 1903 г. предложил новый метод анализа таких смесей, названный им хро-матографическим.
| * Емкость поглощения почв относят к 100 г почвы и называют обменной поглотительной способностью почвы. ** Борис Петрович Никольский (род. 1900 г.)—академик, Герой Социалистического Труда, лауреат Ленинской и Государственных премий, глава крупной научной школы в области ионного обмена, автор термодинамического обоснования ионообменной теории стеклянного электрода, |
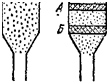
Сущность метода заключается в следующем. Раствор исследуемой смеси вводят в «хроматографическую колонку» — стеклянную трубку, заполненную адсорбентом, предварительно промытым, а затем пропитанным растворителем. Компоненты смеси адсорбируются в верхней части колонки, не разделяясь или разделяясь лишь частично; образуется первичная хроматограмма (рис. 98, а). Затем ее «проявляют». Для этого в колонку подают чистый растворитель (элюент), который десорбирует ранее адсорбированные вещества и перемещает их со своим потоком вниз по колонке. При
|
|
|
 |
 |
ии
иыы
С
JILa,
V
движении но колонке происходят многократные акты адсорбции и десорбции, приводящие к разделению компонентов смеси в соответствии с законом адсорбционного замещения М. С. Цвета (1910 г.), который состоит в следующем: если растворенные вещества А, В, С,... по своему относительному сродству к адсор-0енту образуют адсорбционный ряд А > В >■ С..., тогда каждый из членов адсорбционного ряда вытесняет последующий и, в свою очередь, вытесняется предыдущими, более сильно адсорбирующимися. В результате на колонке образуется проявленная хромато-грамма (рис. 98,6). М. С. Цвет применил этот метод для разделения на адсорбентах белого цвета (мел, оксид кальция, крахмал, целлюлоза) смеси пигментов листьев растений. Проявленная хро-матограмма расцвечивалась зонами разнообразной окраски. Отсюда возникло название предложенного М. С. Цветом метода — хроматография («цветозапись» от греч. «хромое» — цвет, «графе» — писать).
Продолжая промывание колонки растворителем, достигают выхода из нее разделяющихся веществ, которые обнаруживают путем анализа последовательных порций вытекающего из колонки раствора (элюата). Если построить выходную кривую, т.е. график зависимости концентрации элюата (С) от объема пропущенного через колонку раствора (V), то па этой кривой выходу Компонентов исходной смеси из колонки соответствуют хромато-графические пики (рис. 98, в). Часто ие происходит полного разделения компонентов и отдельные пики взаимно перекрываются. Построение выходных кривых является наиболее распространенной формой колоночной хроматографии, так как не связано ни с окраской разделяемых компонентов, ни с цветом адсорбента.
В 1936 г. М. М. Дубинин осуществил адсорбционную хроматографию паров; в последующие годы появились новые варианты хроматографического метода. В настоящее время хроматографией называют такие физико-химические методы разделения компонентов смесей газов, паров, жидкостей или растворенных веществ, которые осуществляют путем сорбции в динамических условиях.
|
|
|
В зависимости от преобладающего физико-химического сорбционного процесса, определяющего разделение компонентов смеси, различают хроматографшо адсорбционную, ионообменную и распределительную. Разделяемые компоненты могут находиться в подвижной жидкой пли газовой фазе, а неподвижная фаза может быть как твердой, так и жидкой. Зерна адсорбента или ионита могут заполнять колонну (колоночная хроматография) или составлять тонкий плотный слой на стеклянной пластинке (тонкослойная хроматография).
Создание и совершенствование хроматографических методов исследования в значительной степени обусловило быстрые темпы развития современной молекулярной биологии, химии редкоземельных и трансурановых элементов. Хроматографические методы выделения и разделения разнообразных веществ осуществлены также в крупных промышленных масштабах.
Большое значение для анализа очень малых объемов растворов (0,01—0,1 мл) приобрела распределительная хроматография на бумаге, предложенная Консденом (Англия) в 1944 г. Она основана на том, что между двумя несмешивающимися жидкостями третий компонент распределяется в соответствии с характерным для этого вещества коэффициентом распределения, представляющим отношение его концентраций в граничащих жидкостях (закон рас-п р е д е л е н и я, см. § 76).
Для осуществления хроматографического процесса необходимо, чтобы один слой жидкости перемещался относительно другого. В этом случае распределение растворенных веществ между двумя слоями жидкости происходит многократно в динамических условиях. При хроматографии на бумаге одна, более полярная жидкость сорбируется волокнами бумаги, образуя фиксированную (неподвижную) жидкую фазу; другая, менее полярная жидкость, смачивая волокна бумаги, поднимается по листу в силу явления капиллярного поднятия.
|
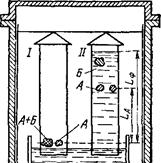
На рис. 99 показана, схема распределительной хроматографии на бумаге («восходящая хроматография»). На стартовую линию полости хроматографической бумаги раздельно наносят по капле исследуемого раствора смеси веществ (А + Б) и предполагаемого компонента смеси — «свидетеля» (рис. 99,/). Нижний край полоски бумаги погружают в растворитель. Когда фронт растворителя почти достигнет верхнего края полоски бумаги, пройдя путь Ьф (рис. 99,//), компоненты исходной смеси, при правильно подобранной системе растворителей, разделяются на ряд пятен, которые выявляют соответствующими цветными реакциями на ожидаемые компоненты и сравнением с положением пятен «свидетелей». Путь, пройденный компонентом А исходной смеси. (LA), определяется коэффициентом распреде-
|
|
|
Рис. 99. Восходящая распределительная хроматография на бумаге,
ления для данного вещества. Относительная величинз этого яугЛ Ьл/Ьф, обозначаемая RfA, является характерной для каждого вещества в определенной системе растворителей.
112. Электрокинетические явления. Электрскинетнческими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания). Перенос коллоидных частиц в электрическом поле называется электрофорезом, а течение жидкости через капиллярные системы под влиянием разности потенциалов — электроосмосом. Оба эти явления были открыты профессором Московского университета Ф. Ф. Рейс-сом в 1809 г.
Электрокинетические явления свидетельствуют о том, что на границе раздела фаз возникает двойной электрический ело й, представляющий собой тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. В дисперсных системах двойной электрический слой образуют ионы и дипольные молекулы. Ионный двойной электрический слой возникает либо в результате диссоциации ионогенных групп вещества твердой фазы, либо вследствие избирательной адсорбции ионов, достраивающих кристаллическую решетку твердой фазы. В результате на границе между твердой фазой и раствором возникает подобие конденсатора, внутренняя обкладка которого образована потенциалопределяющими ионами, а наружная — противоионами.
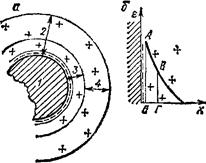
Возникновение двойного электрического слоя путем избирательной адсорбции ионов рассмотрим на примере получения коллоидных частиц Agl при взаимодействии AgN03 и KI в их сильно разбавленных растворах при небольшом избытке KI-
На поверхности кристаллов преимущественно адсорбируются ионы, идентичные ионам, образующим кристаллическую решетку, либо сходные с ними. В рассматриваемом случае будут адсорбироваться ионы I-, и поверхность кристалликов Agl приобретает отрицательный заряд. Межфазовый потенциал, или е-потеициал (греч, е — «эпсилон»), представляет собой работу против ку-
|
лоновских сил, необходимую для переноса единицы заряда противоположного знака с поверхности кристалла в бесконечность.
Противоионы (в данном случае ионы К+) находятся под действием электрического поля заряженной
Рис. 100. Схема строения коллоидной мицеллы (а) и изменения потенциала (<Г) в двойном электрическом слое:
/ — ядро; 2 — двойной электрический слой|
3 — его адсорбционная часть; 4 — его диф«
фузная часть; А Б — межфазовый е-потеи*
циал; ВГ ~ электрокииетический ф-потен.
цнал; «—» — потенциалопределяющиа
ионы; *±» ™ протнвоионы,

|
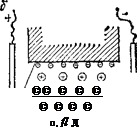 Рис. 101. Схема передвижения коллокдной частицы при электрофорезе (а) и электроосмоти-чес^ого переноса жидкости через кааилляр {К — внутренняя поверхность капилляра). Поверхности коллоидной частицы и капилляра заряжены от* рица гельно.
Рис. 101. Схема передвижения коллокдной частицы при электрофорезе (а) и электроосмоти-чес^ого переноса жидкости через кааилляр {К — внутренняя поверхность капилляра). Поверхности коллоидной частицы и капилляра заряжены от* рица гельно.
 поверхости и теплового движения, стремящегося равномерно распределить их в объеме. Это приводит к закономерному динамическому распределению протн-
поверхости и теплового движения, стремящегося равномерно распределить их в объеме. Это приводит к закономерному динамическому распределению протн-
воионов подобно облаку, плотность которого убывает по мере удаления от заряженной поверхности. Внешняя граница этого облака противоиоиов определяет толщину двойного электрического слоя (рис. 100).
При относительном перемещении фаз, из-за гидратации твердой поверхности и ионов граница скольжения проходит на некотором расстоянии от твердой поверхности. В результате этого двойной электрический слой подразделяется на плотную (адсорбционную) и диффузную части (рис. 100).
Адсорбционная (плотная) часть двойного электрического слоя состоит из потенциалопределяющих ионов и части противоиоиов. Диффузная часть двойного электрического слоя образована остальными противоионами. Скорость перемещения фаз в электрическом поле определяется величиной потенциала на поверхности скольжения, который поэтому назван электрокинетическим потенциалом и кратко обозначается как ^-потенциал (дзета-потенциал). Этому потенциалу приписывают знак заряда твердой поверхности.
В постоянном внешнем электрическом поле коллоидная частица перемещается к электроду, знак заряда которого противоположен знаку заряда поверхности коллоидной частицы (рис. 101, а). Электроосмотический перенос жидкости направлен к электроду, имеющему тот же знак, что и поверхность капилляра К (рис. 101,6). В этом случае в электрическом поле подвижны гид-ратированные противоиоиы, которые увлекают прилегающие к ним слон воды.
Изменение структуры двойного электрического слоя возможно в нескольких направлениях. При очень малых концентрациях электролитов, по мере заполнения активных центров поверхности потенциалопределяющими ионами, будет происходить увеличение е-потенциала. Противоионы с высокой адсорбционной способностью (например, многозарядные ионы) могут проникнуть в адсорбционный слой в количествах, сверхэквивалентных первоначальным потеициалопре-деляющим нонам, вызывая изменение знака заряда поверхности с соответствующей перестройкой всего двойного электрического слоя (перезарядка кол-л о и д о в).
Диффузная часть двойного электрического слоя наиболее лабильна и изменчива. Противоионы обмениваются на другие ионы
того же знака. Повышение концентрации раствора приводит к «вытеснению» противоионов из диффузной в плотную часть двойного электрического слоя. Толщина двойного электрического слоя и величина ^-потенциала уменьшаются. При некоторой концентрации раствора (примерно 0,1 н.) все протнвоионы оказываются вытесненными в адсорбционный слой и ^-потенциал становится равным нулю. В этом случае изменение межфазового потенциала от его максимального значения на поверхности твердой фазы до нулевого целиком происходит в пределах адсорбционного слоя. Такое состояние коллоидной мицеллы называют изоэлектри-ч е с к и м состоянием.
Из сказанного следует, что электрокинетические явления проявляются в разбавленных растворах электролитов (<0,1 и.). Электрокинетический потенциал имеет порядок 0,001—0,1 В. Несмотря на небольшую величину, ^-потенциал играет существенную роль в устойчивости коллоиднодисперсных систем (см. § 113).
Электрокинетические явления находят практическое применение. Так, с помощью электрофореза проводят формование различных изделий из тонких взвесей с последующим их спеканием. Метод электрофореза широко применяют для разделения, выделения и исследования биоколлоидов, особенно белков. Простой его вариант, называемый электрофорезом на бумаге, состоит в том, что нанесенное на полоску бумаги пятно исследуемой смеси белков разделяется на компоненты по величине их заряда, а следовательно, и скорости движения в поле постоянного электрического тока. Этим методом исследуют качественный и количественный состав белков крови и других биологических жидкостей.
Путем электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических и других сооружений.
Возникновение электрических полей при течении грунтовых вод помогает в геологической разведке полезных ископаемых и водных источников.
113. Устойчивость и коагуляция дисперсных систем. Как указывалось в § 106, качественная особенность дисперсных систем состоит в их агрегативной неустойчивости.
Предотвращение агрегации первичных дисперсных частиц возможно в результате действия трех факторов устойчивости дисперсных систем: 1) кинетического, 2) электрического и 3) структурно-механического.
Необходимым условием слипания двух частиц дисперсной фазы является их сближение, достаточное для проявления сил притяжения. Если частота столкновений коллоидных частиц мала, то дисперсная система может быть устойчивой (кинетический фактор устойчивости). Это может иметь место при очень малой концентрации дисперсных частиц (например, в некоторых аэрозолях) или при очень большой вязкости дисперсионной среды (например, в дисперсных системах типа Ti — Тг).
Рис. 102. Схема перекрывания ионных атмосфер двух ---—..„
коллоидных частиц. >" ~ Ч
у_ ^ д - __ -X
Большинство устойчивых дисперс-;' (?$М%хУ-- \
ных систем кроме дисперсной фазы и - К-^рШт/^ - I
дисперсионной среды содержат еще \ X.trt-y \-/' ^v^> -! 3-й компонент, являющийся стабилиза- N _ ^\ _ /
тором дисперсности. Стабилизатором "----- *' ---
могут быть как ионы, так и молекулы,
в связи с чем различают два механизма стабилизации дисперсных систем: электрический и молекулярно-адсорбционный (стр. 324),
Электрическая стабилизация дисперсных систем связана с возникновением двойного электрического слоя на границе раздела фаз. Такая стабилизация имеет основное значение для получения устойчивых лиозолей и суспензий в полярной среде, например в воде. В любом гидролизе все коллоидные частицы имеют одинаковый знак заряда. Однако коллоидная мицелла в целом электронейтральна в результате образования двойного электрического слоя. Поэтому электростатическое отталкивание между коллоидными частицами (электрический фактор устойчивости) возникает только при достаточном нх сближении, когда происходит перекрывание их ионных атмосфер (рис. 102). Потенциальная энергия электростатического отталкивания тем больше, чем больше перекрывание диффузных частей двойного электрического слоя коллоидных частиц, т. е. чем меньше расстояние (х) между ними и чем больше толщина двойного электрического слоя.
Кроме электростатического отталкивания между коллоидными частицами, как и между молекулами любого вещества, действуют межмолекулярные силы притяжения, среди которых наибольшую роль играют дисперсионные силы. Действующие между отдельными молекулами дисперсионные силы быстро убывают с увеличением расстояния между ними. Но взаимодействие коллоидных частиц обусловлено суммированием дисперсионных сил притяжения между всеми молекулами, находящимися на поверхности контакта коллоидных частиц. Поэтому силы притяжения между коллоидными частицами убывают медленнее и проявляются на больших расстояниях, чем в случае отдельных молекул.
Потенциальная энергия взаимодействия (U) между коллоидными частицами представляет собой алгебраическую сумму потенциальной энергии электростатического отталкивания (0Э) и потенциальной энергии дисперсионного притяжения (£/д) между ними:
U шш £/д + U3
Если U3 > £/д (по абсолютной величине), то отталкивание преобладает над притяжением и дисперсная система устойчива. Если
| X | ||
| // / 1 12 1 1 1 i | ||
| *! II S I S О; IS is § ^1 |
Рве. 103. Потенциальная анергия взаимодействия s между двумя одинаково заряженными частицами!
1 — электрическое отталкивание (Уэ); 2—диспер. сиониое притяжение (U„y, 3—результирующая энергия взаимодействия (У); 4—то же, ио прн более крутом падении кривой Г, х—расстояние между ча* стицами; Умакс—потенциальный барьер взаимодействия дисперсных частиц.
£/э < с7д, то происходит слипание сталкивающихся при броуновском движении коллоидных частиц в более крупные агрегаты и седиментация последних. Коллоидный раствор коагулирует, т. е. разделяется на коагулят (осадок) и дисперсионную среду.
В этом состоит сущность теории электрической стабилизации и коагуляции дисперсных систем, развитой впервые Б. В. Деряги-ным * (1937 г.), а затем Л. Д. Ландау и голландскими учеными Фервеем и Овербеком (1948 г.); по первым буквам фамилий авто-, ров ее называют теорией ДЛФО.
| * Борис Владимирович Дерягин (род. 1902 г.)—советский фв> зико-химик, член-корреспоидеит Академии иаук СССР, автор современной тео«рии устойчивости и коагуляции коллоидов, электрической теории склеивания и прилипания, важных исследований в области аэрозолей, |
На рис. 103 приведены зависимости величин £УД и U3 от расстояния между коллоидными частицами. При этом, как принято в физике, потенциальной энергии притяжения приписывается знак минус, а отталкивания — знак плюс. Как видно, результирующая энергия взаимодействия (кривая 3 на рис. 103) приводит к притяжению (U < 0) на очень малых и отталкиванию (U > 0) на больших расстояниях между частицами. Решающее значение для устойчивости дисперсных систем имеет величина потенциального барьера отталкивания (£/маКс), которая, в свою очередь, зависит от хода кривых £/д и U3. При больших значениях этого барьера коллоидная система устойчива. Слипание коллоидных частиц возможно лишь при достаточном их сближении. Это требует преодо-. ления потенциального барьера отталкивания. При некоторых небольших положительных значениях £/макс (кривая 3) преодолеть его могут лишь немногие коллоидные частицы с достаточно боль-» шой кинетической энергией. Это соответствует стадии медленной коагуляции, когда только небольшая часть соударений коллоидных частиц приводит к их слипанию. При медленной коагуляции со временем происходит некоторое уменьшение общего числа кол* лоидных частиц в результате образования агрегатов из 2—3 пер< вичных частиц, но коагулят не выпадает. Подобную коагуляцию, не сопровождающуюся видимым изменением коллоидного раствора, называют скрытой коагуляцией. При дальнейшем
уменьшении потенциального барьера скорость коагуляции, характеризуемая изменением числа частиц в единицу времени, возрастает. Наконец, если потенциальный барьер переходит из области отталкивания в область притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция, когда каждое соударение коллоидных частиц приводит к их слипанию; в коллоидном растворе образуется осадок — коагулят, происходит явная коагуляция.
Потенциальный барьер отталкивания {Ишлкс) возникает в результате суммирования сил отталкивания и притяжения, действующих между коллоидными частицами. Поэтому все факторы, влияющие на ход кривых 1 и 2 (рис. 103), приводят к изменению как величины £УмаКс, так и положения максимума (т. е. расстояния х, соответствующего £/Макс) ■
Значительное уменьшение UMaKC происходит в результате изменения потенциальной энергии электростатического Отталкивания (т.е. хода кривой 1), вызванного добавлением электролитов к коллоидному раствору. С увеличением концентрации любого электролита происходит перестройка двойного электрического слоя, окружающего коллоидные частицы: все большая часть противо-ионов вытесняется из диффузной в адсорбционную часть двойного Электрического слоя. Толщина диффузной части двойного электрического слоя (слой 4 на рис. 100), а вместе с ней и всего двойного эле-ктрического слоя (слой 2 на рис. 100) уменьшается. Поэтому кривая потенциальной энергии электростатического отталкивания снижается более круто, чем показанная на рис. 103 кривая /. В результате этого потенциальный барьер отталкивания (£/макс) уменьшается и смещается в сторону меньшего расстояния между коллоидными частицами. Когда двойной электрический слой сжимается до толщины адсорбционного слоя (слой 8 на рис. 100), то вся кривая взаимодействия дисперсных частиц оказывается в области притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция. Такое изменение устойчивости коллоидного раствора происходит при добавлении любого электролита.
Коагулирующее действие электролитов характеризуют порогом коагуляции, т.е. наименьшей концентрацией электролита, вызывающей коагуляцию. В зависимости от природы электролита и коллоидного раствора порог коагуляции изменяется в пределах от Ю-5 до 0,1 моль в литре золя. Наиболее существенное влияние на порог коагуляции оказывает заряд коагулирующего иона электролита, т. е. иона, заряд которого противоположен по знаку заряду коллоидной частицы.
Многозарядные противоионы электролита имеют повышенную адсорбционную способность по сравнению с однозарядными и проникают в адсорбционную часть двойного электрического слоя в больших количествах. При этом порог коагуляции уменьшается не пропорционально заряду противоиона, а значительно быстрее.
Блестящим подтверждением теории ДЛФО явился расчет Б. В. Дерягиным и Л. Д. Ландау (1941 г.) соотношения значений порогов коагуляции вызываемой электролитами, содержащими ионы с разной величиной заряда. Оказалось, что порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона. Следовательно, значения порогов коагуляции для одно-, двух-, трех- и четырехзарядных ионов должны относиться, как
1: С/г)6: С/з)6: СА)6 = 1: 0,016: 0,0014: 0,00024
что близко к соотношениям концентраций электролитов, которые
наблюдались при коагуляции разнообразных гидрозолей. Сказан-
ное иллюстрируют данные табл. 22, где приведены эквивалентные
концентрации электролитов (Ск), вызывающие коагуляцию гидро-
золя оксида мышьяка (III).,
Таблица 22. Пороги коагуляции (С„) отрицательно заряженного золя As2Oi электролитами
| Электролит | СК.Ю3, н. | Электролит | CK.i0', н. | (ck)x | |
| (ck)liC1 | <ck)liC1 | ||||
| LiCl | 58,4 | 1,00 | MgCl2 | 0,717 | 0,012 |
| NaCl | 51,0 | 0,87 | CaCl2 | 0,649 | 0.011 |
| КС1 | 49,5 | 0,85 | SrCl2 | 0,635 | 0,011 |
| KN03 | 50,0 | 0,86 | A1C13 | 0,093 | 0,0016 |
Молекулярно-адсорбционная стабилизация дисперсных систем играет большую роль в устойчивости дисперсий как в водной, так и в неводных средах. Дисперсные системы в неводных средах в принципе менее устойчивы, чем в водной среде. В неполярной и не содержащей воды дисперсионной среде частицы дисперсной фазы лишены электрического заряда. Электрический фактор стабилизации отсутствует. Между дисперсными частицами действуют только силы взаимного притяжения. Ослабление этих сил, приводящее к стабилизации дисперсных систем, может происходить в результате образования вокруг коллоидных частиц адсорбционных слоев из молекул дисперсионной среды и растворенных в ней веществ. Такие слои ослабляют взаимное притяжение частиц дисперсной фазы и создают механическое препятствие их сближению.
Стабилизация дисперсных систем за счет сольватации дисперсной фазы молекулами дисперсионной среды возможна как в полярных, так и в неполярных средах. Так, гидратация частиц глины и кремниевой кислоты имеет существенное значение для устойчивости суспензий глин и золя кремниевой кислоты в водной среде,
Однако стабилизация дисперсных систем значительно более эффективна при добавлении к ним поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений, адсорбирующихся на границе раздела фаз. Адсорбционные слои ПАВ и высокомолекулярных соединений, обладая упругостью и механической прочностью, предотвращают слипание дисперсных частиц. Образование таких молекулярно-адсорбционных твердообразных поверхностных слоев П. А. Ребиндер* назвал структурно-механическим фактором стабилизации дисперсных систем. Этот механизм стабилизации играет основную роль при получении предельно устойчивых высококонцентрированных пен, эмульсий, коллоидных растворов и суспензий не только в неводиых, но и в водных средах. Для структурно-механической стабилизации дисперсий в водной среде применяют мыла щелочных металлов, белки, крахмал, а в неводиых средах—мыла щелочноземельных металлов, смолы, каучуки. Такие вещества называют защитными коллоидами.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!