
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сильные и слабые электролиты, их характеристика
|
|
|
|
Все вещества можно разделить на электролиты и неэлектролиты. К электролитам относятся вещества, растворы или расплавы которых проводят электрический ток (например, водные растворы или расплавы KCl, H3PO4, Na2CO3). Вещества неэлектролиты при расплавлении или растворении электрический ток не проводят (сахар, спирт, ацетон и др.).
Электролиты подразделяются на сильные и слабые. Сильные электролиты в растворах или расплавах полностью диссоциируют на ионы. При написании уравнений химических реакций это подчеркивается стрелкой в одном направлении, например:
HCl→ H+ + Cl-
Ca(OH)2 → Ca2+ + 2OH-
К сильным электролитам относятся вещества с гетерополярной или ионной кристаллической структурой (таблица 1.1).
Таблица 1.1 Сильные электролиты
| Классы веществ | Примеры | Диссоциация электролита |
| Сильные кислоты | HCl, HNO3, HBr, HI, HClO4 | HCl→H+ + Cl- |
| Сильные основания | KOH, Ca(OH)2, Ba(OH)2, NaOH | KOH→K+ + OH- |
| Хорошо растворимые соли | NaCl, MgSO4, KI, NH4NO3, CH3COONa | NaCl→Na+ + Cl- |
Слабые электролиты на ионы распадаются лишь частично. Наряду с ионами в расплавах или растворах данных веществ присутствуют в подавляющем большинстве недиссоциированные молекулы. В растворах слабых электролитов параллельно с диссоциацией протекает обратный процесс - ассоциация, т.е соединение ионов в молекулы. При записи уравнения реакции это подчеркивается двумя противоположно направленными стрелками.
CH3COOH D CH3COO- + H+
К слабым электролитам относятся вещества с гомеополярным типом кристаллической решетки (таблица 1.2).
Таблица 1.2 Слабые электролиты
| Классы веществ | Примеры | Диссоциация электролита |
| Малорастворимые соли | AgCl, Hg2I2 | AgCl ⇄ Ag+ + Cl- |
| Слабые кислоты | H2S, H2CO3, H3PO4, HF, органические кислоты | H3PO4⇄ H+ + H2PO4- |
| Слабые основания | Cu(OH)2, Fe(OH)3, Al(OH)3 | Cu(OH)2⇄ CuOH+ + OH- |
|
|
|
Равновесное состояние слабого электролита в водном растворе количественно характеризуют степенью электролитической диссоциации и константой электролитической диссоциации.
Степень электролитической диссоциации α представляет собой отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного электролита:
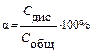
Степень диссоциации показывает, какая часть от общего количества растворенного электролита распадается на ионы и зависит от природы электролита и растворителя, а также от концентрации вещества в растворе, имеет безразмерную величину, хотя обыкновенно ее выражают в процентах. При бесконечном разбавлении раствора электролита степень диссоциации приближается к единице, что соответствует полной, 100%-ной, диссоциации молекул растворенного вещества на ионы. Для растворов слабых электролитов α <<1. Сильные электролиты в растворах диссоциируют полностью (α =1). Если известно, что в 0,1 М растворе уксусной кислоты степень электрической диссоциации α =0,0132, это означает, что 0,0132 (или 1,32%) общего количества растворённой уксусной кислоты продиссоциировало на ионы, а 0,9868 (или 98,68%) находится в виде недиссоциированных молекул. Диссоциация слабых электролитов в растворе подчиняется закону действия масс.
В общем виде обратимую химическую реакцию можно представить как:
a A + b B D d D + e E
Скорость реакции прямо пропорциональна произведению концентрации реагирующих частиц в степенях их стехиометрических коэффициентов. Тогда для прямой реакции
V1= k 1 [A] a [B] b,
а скорость обратной реакции
V2= k 2 [D] d [Е] е.
В некоторый момент времени скорости прямой и обратной реакции выровняются, т.е.
V1 = V2
Такое состояние называют химическим равновесием. Отсюда
k 1 [A] a [B] b = k 2[D] d [Е] е
|
|
|
Сгруппировав постоянные величины с одной стороны, а переменные- с другой стороны, получим:

Таким образом, для обратимой химической реакции в состоянии равновесия произведение равновесных концентраций продуктов реакции в степенях их стехиометрических коэффициентов, отнесенное к такому же произведению для исходных веществ есть величина постоянная при данных температуре и давлении. Численное значение константы химического равновесия К не зависит от концентрации реагирующих веществ. Например, константу равновесия диссоциации азотистой кислоты в соответствии с законом действия масс можно записать в виде:
HNO2 + H2OD H3O+ + NO2-
 .
.
Величину Ка называют константой диссоциации кислоты, в данном случае азотистой.
Аналогично выражается и константа диссоциации слабого основания. Например, для реакции диссоциации аммиака:
NH3 + H2O DNH4+ + OH-
 .
.
Величину Кb называют константой диссоциации основания, в данном случае аммиака. Чем выше константа диссоциации электролита, тем сильнее электролит диссоциирует и тем выше концентрации его ионов в растворе при равновесии. Между степенью диссоциации и константой диссоциации слабого электролита существует взаимосвязь:

Это математическое выражение закона разбавления Оствальда: при разбавлении слабого электролита степень его диссоциации увеличивается.Для слабых электролитов при К ≤1∙ 10 -4и С ≥0,1 моль/л используют упрощенное выражение:
К = α 2 ∙ С или α 
Пример1. Вычислите степень диссоциации и концентрацию ионов [OH-] и [ NH4+] в 0,1 М растворе гидроксида аммония, если К NH4OH =1,76∙10 -5
Дано: NH4OH
К NH4OH =1,76∙10 -5
α -?
Решение:
Так как электролит является достаточно слабым (К NH4OH =1,76∙10 –5<1∙ 10 - 4 ) и раствор его не слишком разбавлен, можно принять, что:
 или 1,33%
или 1,33%
Концентрация ионов в растворе бинарного электролита равна C ∙α, так как бинарный электролит ионизирует с образованием одного катиона и одного аниона, то[OH-] = [ NH4+]=0,1∙1,33∙10 -2 =1,33∙10 -3 (моль/л).
Ответ: α=1,33 %; [OH-] = [ NH4+]=1,33∙10 -3 моль/л.
Теория сильных электролитов
Сильные электролиты в растворах и расплавах полностью диссоциируют на ионы. Однако экспериментальные исследования электропроводности растворов сильных электролитов показывают, что ее величина несколько занижена по сравнению с той электропроводностью, которая должна бы быть при 100 % диссоциации. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Гюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Вокруг каждого иона образуется “ионная атмосфера” из ионов противоположного знака заряда, которая тормозит движение ионов в растворе при пропускании постоянного электрического тока. Кроме электростатического взаимодействия ионов, в концентрированных растворах нужно учитывать ассоциацию ионов. Влияние межионных сил создает эффект неполной диссоциации молекул, т.е. кажущейся степени диссоциации. Определенная на опыте величина α всегда несколько ниже истинной α. Например, в 0,1 М растворе Na2SO4 экспериментальная величина α =45 %. Для учета электростатических факторов в растворах сильных электролитов пользуются понятием активности (а). Активностью иона называют эффективную или кажущуюся концентрацию, согласно которой ион действует в растворе. Активность и истинная концентрация связаны между собой выражением:
|
|
|
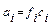 ,
,
где f – коэффициент активности, который характеризует степень отклонения системы от идеальной из-за электростатических взаимодействий ионов.
Коэффициенты активности ионов зависят от величины µ, называемой ионной силой раствора. Ионная сила раствора является мерой электростатического взаимодействия всех ионов, присутствующих в растворе и равнаполовине суммы произведений концентраций (с) каждого из присутствующих в растворе ионов на квадрат его зарядового числа (z):
 .
.
В разбавленных растворах (µ<0,1М) коэффициенты активности меньше единицы и уменьшаются с ростом ионной силы. Растворы с очень низкой ионной силой (µ < 1∙10-4 М) можно считать идеальными. В бесконечно разбавленных растворах электролитов активность можно заменить истинной концентрацией. В идеальной системе a = c и коэффициент активности равен 1. Это означает, что электростатические взаимодействия практически отсутствуют. В очень концентрированных растворах (µ>1М) коэффициенты активности ионов могут быть больше единицы. Связь коэффициента активности с ионной силой раствора выражается формулами:
|
|
|
 при µ <10-2
при µ <10-2
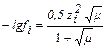 при 10-2 ≤ µ ≤ 10-1
при 10-2 ≤ µ ≤ 10-1
 + 0, 1z 2µ при 0,1< µ <1
+ 0, 1z 2µ при 0,1< µ <1
Константа равновесия, выраженная через активности, называется термодинамической. Например, для реакции
a A + b B  d D + e E
d D + e E
термодинамическая константа имеет вид:
 .
.
Она зависит от температуры, давления и природы растворителя.
Поскольку активность частицы  , то
, то

=  .
.
где К С - концентрационная константа равновесия.
Значение К С зависит не только от температуры, природы растворителя и давления, но и от ионной силы m. Так как термодинамические константы зависят от наименьшего числа факторов то, следовательно, являются наиболее фундаментальными характеристиками равновесия. Поэтому в справочниках приводятся именно термодинамические константы. Величины термодинамических констант некоторых слабых электролитов приведены в приложении данного пособия.
Пример2. Вычислите ионную силу, коэффициенты активности и активности ионов в 0,01 M растворе Fe(NO3)3.
Дано:
Fe (NO3)3
C =0,01 моль/л
μ -?
f -?
a -?
Решение: Поскольку с (Fe3+) = 0,01 моль/л; с (NO3-) = 0,03 моль/л, то

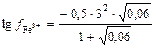 = -0,886;
= -0,886;
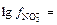
 = -0,098.
= -0,098.
Следовательно,  = 0,13;
= 0,13; 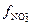 = 0,80.
= 0,80.
Активности ионов соответственно равны:

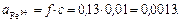
Ответ: μ=0,06,  = 0,13;
= 0,13; 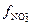 = 0,80,
= 0,80,  =0,0013 моль/л,
=0,0013 моль/л,  =0,024 моль/л.
=0,024 моль/л.
С ростом заряда иона коэффициент активности и активность иона уменьшается.
Вопросы для самоконтроля:
- Что такое идеальная система? Назовите основные причины отклонения реальной системы от идеальной.
- Что называют степенью диссоциации электролитов?
- Приведите примеры сильных и слабых электролитов.
- Какая взаимосвязь существует между константой диссоциации и степенью диссоциации слабого электролита? Выразите её математически.
- Что такое активность? Как связаны активность иона и его истинная концентрация?
- Что такое коэффициент активности?
- Как влияет заряд иона на величину коэффициента активности?
- Что такое ионная сила раствора, ее математическое выражение?
- Запишите формулы для расчета коэффициентов активности индивидуальных ионов в зависимости от ионной силы раствора.
- Сформулируйте закон действия масс и выразите его математически.
- Что такое термодинамическая константа равновесия? Какие факторы влияют на ее величину?
- Что такое концентрационная константа равновесия? Какие факторы влияют на ее величину?
- Как связаны термодинамическая и концентрационная константы равновесия?
- В каких пределах могут изменяться величины коэффициента активности?
- В чем заключаются основные положения теории сильных электролитов?
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 12563; Нарушение авторских прав?; Мы поможем в написании вашей работы!