
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление рН буферного раствора
|
|
|
|
Область постоянного значения рН определяется константой диссоциации слабой кислоты или слабого основания и соотношением концентраций сопряженной пары: кислоты и основания. Выведем формулу для расчета рН на примере буферной системы, состоящей из одноосновной кислоты НАи её соли MeA. В растворе слабой кислоты существует равновесие:
НA ⇄ H - + А-
Соль является сильным электролитом и диссоциирует полностью:
MeA → Me + + А-,
Константа диссоциации кислоты НА:
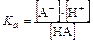 ,
,
Концентрация [А-] в буферном растворе будет определяться концентрацией соли, т.е. [А-] = C А- - так как в буферном растворе слабая кислота образует небольшое количество [А-]. Поскольку диссоциация слабой кислоты незначительна и к тому же подавляется присутствием одноименных ионов соли, можно допустить, что концентрация недиссоциированных молекул равна общей концентрации кислоты[HA]= C HА.
Подставляя эти обозначения в уравнение для константы диссоциации, получим:
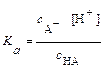 ,
,
откуда
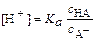
Обычно его используют в логарифмическом виде:
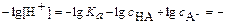
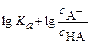 или
или 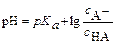
По аналогии можно вывести формулу для расчёта рН буферной смеси состава MOH + MA (например, NH4OH + NH4Cl). В данном случае водородный показатель вычисляют по формуле:
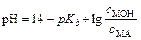 ,
,
рН буферных смесей зависит от отношения концентраций компонентов буферных смесей и от природы электролита. С разбавлением рН буферной смеси не меняется, так как пропорционально меняется лишь концентрация компонентов, а отношение концентраций компонентов сохраняется прежним. Если концентрации компонентов буферной системы одинаковы, то
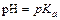 илирН=14- рКb
илирН=14- рКb
Отношение концентраций компонентов буферного раствора обычно находится в пределах от 10:1 до 1:10. В таких растворах водородный показатель будет изменяться от 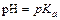 -1 до
-1 до 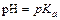 + 1 или от рН=14- рКb -1 до рН=14- рКb +1. Следовательно, область эффективного действия буферного раствора лежит в интервале значений:
+ 1 или от рН=14- рКb -1 до рН=14- рКb +1. Следовательно, область эффективного действия буферного раствора лежит в интервале значений:
|
|
|

рН=14-(рКb + 1)
Для ацетатного буфера: рН=4,76 + 1. Для аммиачного буфера: рН=14-(4,76 + 1). Если изменение рН происходит более чем, на единицу, то буферный раствор теряет способность поддерживать постоянным значение рН.
Пример 1. Рассчитайте рН буферного раствора, состоящего из 0,5М NH4OH и 0,5М NH4Cl. Как изменится рНданного раствора при добавлении к 1 л этой смеси 0,1 М раствора NaOH и 0,1М раствора HCl? Как изменится рНданного раствора при разбавлении в 10 раз?
Решение: Воспользуемся формулой:
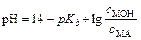
рН = 14-4,76+ 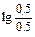 = 9,24
= 9,24
При добавлении к буферному раствору 0,1М HCl концентрация
NH4OH уменьшится на 0,1 М и станет равной 0,4 М, а концентрация NH4Cl возрастает до 0,6 М:
рН=14-4,76+ 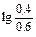 =9,06
=9,06
При добавлении же 0,1М NaOH к 1 л смеси концентрация
NH4OH увеличится до 0,6 М, а концентрация NH4Cl уменьшится до 0,4 М, в результате получим:
рН=14-4,76+ 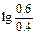 =9,42
=9,42
Таким образом, рН буферного раствора при добавлении к нему сильных кислот и оснований изменился незначительно всего на 0,18 единиц (9,24± 0,18). Буферный раствор стойко поддерживает постоянное значение рН, не позволяя ему измениться ни под действием кислоты, ни под действием щёлочи.
При разбавлении буферного раствора водой концентрации компонентов буферного раствора уменьшаются в 10 раз.
рН = 14-4,76+ 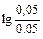 = 9,24.
= 9,24.
рН буферных растворов при разбавлении не изменяется
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 7555; Нарушение авторских прав?; Мы поможем в написании вашей работы!