
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительный потенциал
|
|
|
|
Реакции окисления-восстановления
Задачи для самостоятельного решения.
1. Поясните строение комплексных соединений на примере: K4[Fe(CN)6], Na3[Co(NO2)6], Na3[FeF6].
2. Напишите уравнения диссоциации комплексных соединений:[Ag(NH3)2]Cl, [Cu(NH3)4](OH)2.
3. Сравните устойчивость аквакомплексов, пользуясь справочной литературой:[Al(H2O)6]Cl3, [Co(H2O)6]Cl3.
4. Вычислите равновесные концентрации ионов комплексообразователя и лиганда в 1М растворе К[Ag(СN)2].
Ответ: [6,3∙10-8];[1,26∙10 -7].
- Вычислите равновесные концентрации ионов комплексообразователя и лиганда в 0,1М растворе К2[PbI4].
Ответ:[2,1∙10-3]; [8,3∙10 -3].
- Вычислите концентрацию ионов ртути в 0,1 М растворе К2[HgCl4].
- Выпадет ли осадок иодида серебра при смешивании равных объемов 0,1 М раствора иодида калия и 0,1М раствора К[Ag(СN)2]? Ответ подтвердите расчетом.
Реакции окисления-восстановления используют в аналитической химии для обнаружения ионов, их разделения, растворения металлов, сплавов, малорастворимых соединений, для количественного определения веществ. Расчет равновесий в реакциях окисления-восстановления позволяет выбрать нужный реактив и условия его применения в анализе. Методы расчета основаны на знании величин стандартных окислительно-восстановительных потенциалов, знании констант равновесия реакций окисления-восстановления.
Для обратимой окислительно-восстановительной полуреакции процесс превращения окисленной формы элемента в восстановленную может быть представлен в виде:
Ox + ze D Red,
где символом Ох обозначены элементарные объекты-окислители (атомы, молекулы, ионы), которые присоединяют электроны и восстанавливаются, а символом Red - объекты-восстановители, которые отдают электроны и окисляются. Как видно, окислители и восстановители взаимосвязаны. Они образуют пары элементарных объектов (частиц), называемыми окислительно-восстановительными парами (редоксипарами ). При этом объект Ох именуется окисленной, а объект Red – восстановленной формами таких пар. Превращение Ox + ze DRed называют окислительно-восстановительным переходом (редоксипереходом) или полуреакцией. Любую окислительно- восстановительную реакцию можно представить как сумму двух полуреакций. Например, редоксиреакция
|
|
|
S2O32- + I2DS4O62- + 2I-
является сочетанием двух полуреакций
2S2O32- - 2 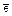 DS4O62-
DS4O62-
I2 + 2 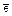 D 2I-
D 2I-
В каждой полуреакции принимает участие окислительно- восстановительная пара, содержащая окисленную и восстановленную формы одного и того же элемента. Количественно окислительно- восстановительные свойства каждой редоксипары характеризуются величиной окислительно- восстановительного потенциала (Е). Чем больше Е, тем больше сила окислителя и меньше - восстановителя.
Окислительно- восстановительный потенциал полуреакции (редоксипотенциал), измеренный в стандартных условиях (р=1атм, Т=250С, a Ox= a Red= 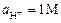 ) относительно стандартного водородного электрода, потенциал которого условно прият равным нулю, называется стандартным потенциалом и обозначается символом E0. Значения E0 представлены в справочной литературе (см. приложение данного пособия). Стандартные потенциалы окислительно-восстановительных пар, рассчитанные с учетом влияния на них ионной силы и рН среды, а также побочных взаимодействий компонентов пар с посторонними (или вспомогательными) частицами в растворе, называют формальными (реальными) потенциалами и выражают уравнением Нернста:
) относительно стандартного водородного электрода, потенциал которого условно прият равным нулю, называется стандартным потенциалом и обозначается символом E0. Значения E0 представлены в справочной литературе (см. приложение данного пособия). Стандартные потенциалы окислительно-восстановительных пар, рассчитанные с учетом влияния на них ионной силы и рН среды, а также побочных взаимодействий компонентов пар с посторонними (или вспомогательными) частицами в растворе, называют формальными (реальными) потенциалами и выражают уравнением Нернста:
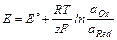 ,
,
где R - газовая постоянная, равная 8,314 Дж/моль×К; F - постоянная Фарадея, равная 96490 Кл/моль. Часто постоянные величины объединяют в одну константу, а натуральный логарифм заменяют десятичным. Значение величины 2,303 RT/F при стандартнойтемпературе 25 °С равно 0,059. Поэтому уравнение Нернста обычно записывают так:
|
|
|
 .
.
Если в редоксипереходе участвуют ионы водорода или гидроксила, то потенциал Е будет зависеть и от их концентрации в растворе:
 .
.
где q - стехиометрический коэффициент при ионе водорода в уравнении реакции.
Пример 1. Вычислить редоксипотенциал пары H3AsO4/HAsO2 при рН 3 и с (H3AsO4) = с (H3AsO2)=1 М.
Решение: Запишем полуреакцию для редоксипары H3AsO4/HAsO2:
H3AsO4 + 2 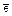 + 2H+ D HAsO2 + 2H2O
+ 2H+ D HAsO2 + 2H2O
По условию задачи рН=3, следовательно, [H+]=10-3М.
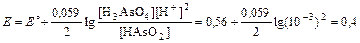 В.
В.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1334; Нарушение авторских прав?; Мы поможем в написании вашей работы!