
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система элементов
|
|
|
|
Атом представляет собой сложную микросистему, состоящую из ядра и движущихся вокруг него электронов. Число электронов в атоме равно заряду его ядра и отвечает порядковому номеру этого элемента в Периодической системе. Свойства атомов определяются зарядом их ядер, числом электронов и их состоянием в атоме. Пространство, в котором наиболее вероятно нахождение электрона, называют атомной орбиталью. Энергетическое состояние электрона в изолированном атоме описывается четырьмя квантовыми числами: главным n, орбитальным l, магнитным ml, спиновым ms.
Главное квантовое число n определяет энергию и размеры электронных орбиталей. Главное квантовое число принимает значения 1, 2, 3, 4, 5, …- и характеризует оболочку или энергетический уровень. Чем больше n, тем выше энергия. Переходы электронов с одной оболочки (уровня) на другую сопровождаются выделением квантов энергии.
Орбитальное квантовое число l определяет форму атомной орбитали. Орбитальные квантовые числа принимают целочисленные значения от 0 до(n- 1). Электроны с орбитальным квантовым числом 0 называются s-электронами. Орбитали и электронные облака имеют сферическую форму.
Электроны с орбитальным квантовым числом 1 называются р-электронами. Орбитали и соответствующие электронные облака имеют форму, напоминающую гантель.
Электроны с орбитальным квантовым числом 2 называют d -электронами. Орбитали имеют более сложную форму, чем р-орбитали.
Электроны с орбитальным квантовым числом 3 получили название f- орбиталей. Форма их орбиталей ещё сложнее, чем у d- орбиталей.
Магнитное квантовое число m характеризует ориентацию орбитали в пространстве. Магнитное квантовое число принимает целочисленные значения от – l до + l, включая 0. Соответственно, для s-подуровня имеется одна орбиталь (ml=0), у р-подуровня – три орбитали (ml=-1, 0, +1), у d-подуровня – пять орбиталей (ml=-2, -1, 0, +1, +2).
|
|
|
Каждый электрон характеризуется также собственным механическим моментом движения, называемым спином.
Спиновое квантовое число ms имеет только два значения +1/2 и -1/2. Положительные и отрицательные значения спина связаны с его направлением.
Запись распределения электронов в атоме по уровням, подуровням и орбиталям называют электронной конфигурацией элемента. Обычно электронная конфигурация приводится для основного состояния атома. В случае, когда один или несколько электронов находятся в возбужденном состоянии, то и электронная конфигурация характеризует возбужденное состояние атома.
Заполнение энергетических уровней электронами в многоэлектронных атомах подчиняется трём принципам:
1. Принцип Паули. В любой атомной или молекулярной системе не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
|
2. Принцип наименьшей энергии. Электроны при заполнении орбиталей занимают прежде всего те орбитали, энергия которых меньше (энергия же орбиталей определяется значением главного n и орбитального l квантовых чисел). Последовательность заполнения атомных орбиталей очередными электронами в соответствии с принципом наименьшей энергии следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→5d1→+4f→5d2-10→ 6p→7s→6d1→5f→6d2…
3. Правило Гунда. Все орбитали заполняются электронами по возможности по одному, и только после этого электроны спариваются.
В соответствии с тем, какая орбиталь заполняется очередным электроном, отличающим данный элемент от предыдущего в периодической системе, все элементы делятся на s-, p-, d- и f- семейства. К s- семейству относятся элементы главных подгрупп I и II групп периодической системы, а также водород и гелий; к p - семейству – элементы главных подгрупп III – VIII групп, к d- семейству – элементы побочных подгрупп, к f- семейству – лантаноиды и актиноиды.
|
|
|
Для составления электронной формулы атома данного элемента необходимо знать положение его в периодической системе. Порядковый номер указывает на заряд ядра его атома, а, следовательно, и на общее число электронов в атоме. Номер периода соответствует количеству энергетических уровней в атоме. Номер группы отвечает числу валентных электронов (электронов, участвующих в образовании химических связей). В атомах элементов главных подгрупп валентные электроны заполняют наружный энергетический уровень (s- или s- и p- состояния). В атомах элементов побочных подгрупп валентные электроны находятся в s- состоянии внешнего энергетического уровня и в d- состоянии предыдущего уровня.
Электронными аналогами называются элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы.
Пример 1. Составить электронную формулу атома магния Mg (элемент s-семейства).
Порядковый номер магния 12, значит, в атоме двенадцать электронов. Магний – элемент III периода – три энергетических уровня в атоме. Элемент главной подгруппы II группы, следовательно, два валентных электрона в s-состоянии находятся в наружном, третьем, энергетическом уровне. Отсюда электронная формула атома магния: 1s22s22p63s2.
Пример 2. Составить электронную формулу атома углерода С (элемент p- семейства).
Порядковый номер 6 – 6 электронов. Период II – два энергетических уровня. Главная подгруппа IV группы – 4 валентных электрона в s- и p- состояниях внешнего энергетического уровня. Электронная формула атома С: 1s22s22p2
Пример 3. Составить электронную формулу титана (элемент d- семейства).
Порядковый номер 22 – двадцать два электрона. IV период – четыре энергетических уровня. Побочная подгруппа IV группы - четыре валентных электрона (два в s-состоянии наружного четвёртого энергетического уровня и два в d-состоянии третьего энергетического уровня). Электронная формула атома титана: 1s22s22p63s23p63d24s2.
|
|
|
Пример 4. Составить электронную формулу атома гадолиния (элемент f- семейства).
Порядковый номер 64 – шестьдесят четыре электрона. VI период – шесть энергетических уровней. Побочная подгруппа III группы – три валентных электрона (два в s-состоянии шестого энергетического уровня и один в d-состоянии пятого энергетического уровня). Очередной электрон, отличающий атом гадолиния от атома предыдущего элемента, заполняет 4f-орбитали: 1s22s22p63s23p63d104s24p64d104f75s25d16s2.
Пример 5. На каком основании хлор и марганец помещают в одной группе периодической системы элементов? Почему их помещают в разных подгруппах?
Электронные конфигурации атомов: Cl 1s22s22p63s23p5 ;
Mn 1s22s22p63s23p63d54s2
Валентные электроны хлора - 3s23p5 , а марганца - 3d54s2 ; таким образом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. На этом основании оба элемента помещают в одну и ту же седьмую группу периодической системы, но в разные подгруппы.
Пример 6. Укажите квантовые числа формирующего электрона для элемента с символом 17.
 Решение. Элемент №17 (атом хлора) расположен в 3-ем периоде и VII А -подгруппе. Электронная конфигурация атома Cl 1s22s22p63s23p5
Решение. Элемент №17 (атом хлора) расположен в 3-ем периоде и VII А -подгруппе. Электронная конфигурация атома Cl 1s22s22p63s23p5
валентные электроны
Электрон, который последним заполняет орбитали атома, называется формирующим и элемент относится к группе, называемой по формирующему электрону.
Следовательно: а) внешние электроны расположены на 3-ем энергетическом слое (главное квантовое число n = 3):
б) электронная конфигурация указывает на расположение пяти электронов (в том числе и формирующего) на p-орбиталях внешнем (третьего) уровня (орбитальное квантовое число l = 1);
в) магнитное квантовое число характеризующее ориентацию орбитали в пространстве можно найти, если графически укажем валентные электроны.
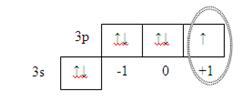
Последний неспаренный электрон (формирующий электрон) находится на р-орбитали с магнитным квантовым числом m l = +1.
|
|
|
в) спиновое квантовое число ms = +1/2.
Задания для самостоятельного решения
Задача 1. Ответьте на следующие вопросы (см. таблицу):
1. запишите краткую электронную конфигурацию по порядковому номеру в периодической системе элементов, графически укажите валентные электроны в нормальном и возбужденном состояниях; определите устойчивые степени окисления в нормальном и возбужденном состояниях;
2. укажите квантовые числа формирующего электрона для элемента с символом;
3. назовите аналоги электронной структуры элемента по формирующему электрону;
| Номер варианта | Вопрос | ||
| Pt | 5р6 | ||
| Fe | 4f7 | ||
| Xe | 2s1 | ||
| Номер варианта | Вопрос | ||
| Mo | 3d5 | ||
| Pu | 6р1 | ||
| Ti | 4s2 | ||
| Am | 5d1 | ||
| Fr | 2р2 | ||
| Mn | 5f14 | ||
| Ru | 4d3 | ||
| Sc | 6s2 | ||
| Y | 2р3 | ||
| Zr | 3d2 | ||
| At | 6s1 | ||
| Th | 6р3 | ||
| Mg | 3d10 | ||
| Ва | 2р4 | ||
| U | 7s2 | ||
| Hg | 5f7 | ||
| Pb | 4d9 | ||
| Br | 3р4 | ||
| Сs | 3s1 | ||
| Ро | 3d8 | ||
| La | 5d4 | ||
| Hf | 6р1 | ||
| Ge | 4d7 | ||
| Сf | 3s2 | ||
| Rn | 4d5 | ||
| Si | 2р2 | ||
| K | 4s1 |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2598; Нарушение авторских прав?; Мы поможем в написании вашей работы!