
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И углы между связями
|
|
|
|
Типы гибридизации, геометрическая форма частиц
| Гибридизация | Геометрическая форма | Угол между связями | Примеры соединений |
| sp | 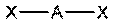 линейная линейная
| 180о | CO2, BeCl2, BeH2 |
| sp2 |  треугольная треугольная
| 120о | BCl3, BF3, NO3- |
| sp3 | 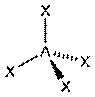 тетраэдрическая тетраэдрическая
| 109о28/ | NH4+, CCl4, XeO4 |
| sp3d | 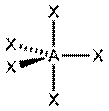 тригонально-бипирамидальная тригонально-бипирамидальная
| 90о, 120о | SF4; PCl5 |
| sp3d2 |  октаэдрическая октаэдрическая
| 90о | SF6 |
Типы связи. Ковалентная связь, образованная однократным перекрыванием электронных облаков по линии, соединяющей центры взаимодействующих атомов, называется σ-связью.
Связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
Поляризуемостью связи называется способность связи становиться полярной или более полярной в результате действия внешнего электрического поля.
2 Ионная связь
Ионная связь образуется между атомами, сильно отличающимися друг от друга величиной электроотрицательности. Такая связь обусловлена электростатическим взаимодействием отрицательно и положительно заряженных ионов в химическом соединении.
Так как электрическое поле имеет сферический характер, то для ионной связи характерна ненасыщенность и ненаправленность. Чисто ионной связи не существует, говорят лишь о доле ионности связи.
3 Металлическая связь
Это химическая связь в металлах, где небольшое число электронов связывает большое число ядер атомов, а сами электроны могут перемещаться в металле. Таким образом, в металлах нелокализованная химическая связь. Это обусловливает их высокую электро- и теплопроводность, металлический блеск и др.
Кристаллическое состояние вещества
В зависимости от природы частиц, которые образуют кристаллическую решётку, различают ионные, атомные, молекулярные и металлические решётки.
|
|
|
В узлах ионной кристаллической решётки расположены положительные и отрицательные ионы. Такие решётки характерны для оксидов, гидроксидов и солей. Все ионные соединения имеют высокую температуру плавления и не летучи.
В узлах молекулярной кристаллической решётки располагаются полярные или неполярные молекулы. Они связаны между собой более слабыми силами, чем атомы или ионы. Поэтому вещества с молекулярной кристаллической решёткой имеют невысокую температуру плавления, они летучи. Например, сахар, камфара, вода, йод, аммиак, диоксид углерода (в твердом состоянии).
В узлах атомной кристаллической решётки располагаются атомы, связанные между собой электронными парами. Например, алмаз. Для веществ с атомной кристаллической решёткой характерны высокая твердость и высокая температура плавления.
В узлах металлической решётки располагаются нейтральные атомы и положительные ионы данного металла. Между ними свободно перемещаются электроны, что обусловливает общие свойства металлов: металлический блеск, пластичность, ковкость, электро- и теплопроводность.
Межмолекулярное взаимодействие
При сближении молекул появляется притяжение, что влечет за собой образование конденсированного (жидкого или твердого) состояния вещества. К основным видам межмолекулярного взаимодействия относятся вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
1. Вандерваальсовы силы. Силы притяжения между молекулами, по предположению Ван-дер-Ваальса, названные вандерваальсовами силами, включают три составляющих.
- Диполь-дипольное взаимодействие возикает при сближении полярных молекул ориентированных, чтобы положительная сторона одного диполя была направлена к отрицательной стороне другого диполя.
|
|
|
- Индукционное взаимодействие возникает при воздействии диполя на неполярную молекулу, превращая её в индуцированный (наведенный) диполь. Между постоянным и наведенным диполем возникает притяжение.
- Дисперсионное притяжение. В результате флуктуации электронной плотности появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул, что вызывает дисперсионное притяжение. Движение мгновенных диполей согласовано, их появление и распад протекает синхронно.
2. Водородная связь. Химическая связь, образованная положительно поляризованным водородом молекулы А – Н и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной; если связь образуется между двумя группами одной и той же молекулы, она называется внутримолекулярной. Водородная связь между молекулами обозначается тремя точками.
А – Н + В – R → А – Н ··∙ В – R

Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атома В.
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (НF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты, или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи. Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплот парообразования и плавления. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства.
Так как многие соединения содержат ковалентные полярные связи Н–О и Н–N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают.
|
|
|
3, Комплексные соединения. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называют комплексными или координационными соединениям.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
Согласно координационной теории Вернера, комплексные соединения состоят из внешней сферы и внутренней. Внутренняя сфера, или комплекс, включает центральный ион или атом, называемый комплексообразователем. Координируемые им ионы или молекулы называются лигандами. В рассмотренном выше примере комплексообразователем является ион меди, а лигандами – молекулы аммиака. Комплексообразователями являются атомы или ионы металлов, имеющие вакантные орбитали. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов.
Клатраты
Клатраты, или соединения включения, образуются в результате включения молекул «гостей» в полости кристалла, состоящего из частиц другого вида – «хозяев». К числу клатратов относятся газовые гидраты, клатраты мочевины и др. В газовых гидратах в полостях кристаллов льда могут находиться молекулы, размеры которых лежат в диапазоне 0,32÷0,92 нм (N2, O2, C2H4, CO2, Cl2, H2S, Ar, Xe, CH4 и др.).
Пример 1. Определите пространственную структуру молекул SbH3 и BH3 и их полярность.
Связи в молекуле SbH3 образуются перекрыванием трёх р-орбиталей атома сурьмы (5s25p3) с тремя s-орбиталями трёх атомов водорода (1s1).
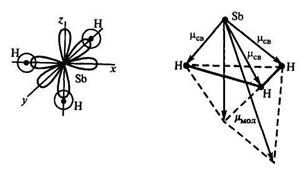 Поскольку 3p-облака ориентированы в трёх взаимно перпендикулярных направлениях (по осям x,y,z), то связи в образовавшейся молекуле SbH3 направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к её основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет пирамидальную структуру.
Поскольку 3p-облака ориентированы в трёх взаимно перпендикулярных направлениях (по осям x,y,z), то связи в образовавшейся молекуле SbH3 направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к её основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет пирамидальную структуру.
Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю, и следовательно, молекула в целом полярна.
|
|
|
 Ковалентные связи в молекуле BH3 образуются перекрыванием трёх гибридных орбиталей атома бора (2s12p2) с s-орбиталями трёх атомов водорода. Гибридные связи направлены под углом 120о. Ядра всех взаимодействующих атомов лежат в одной плоскости. Молекула имеет структуру плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула BH3 неполярна.
Ковалентные связи в молекуле BH3 образуются перекрыванием трёх гибридных орбиталей атома бора (2s12p2) с s-орбиталями трёх атомов водорода. Гибридные связи направлены под углом 120о. Ядра всех взаимодействующих атомов лежат в одной плоскости. Молекула имеет структуру плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула BH3 неполярна.
Пример 2. Распределите молекулы S2, MgO, HF, CO в порядке возрастания полярности связи.
Мерой полярности связи является разница в значениях электроотрицательности (ЭО) атомов, образующих связь: ∆ ЭО s-s =0,0; ∆ЭО Mg – O = 3,5 – 1,2 = 2,3; ∆ ЭО H- F = 4,0 -2,1 =1,9; ∆ЭО С – O = 3,5 – 2,5 = 1,0. Следовательно, молекулы будут распределяться в порядке возрастания полярности связи следующим образом S2, CO, HF, MgO.
Пример 3. Определите тип гидридизацииэлектронных облаков и пространственную конфигурацию структуры молекулы SiCl4.
1. Найдем центральный атом в молекуле SiCl4 (это тот атом, степень окисления которого выше по модулю Si+4Cl4-). У кремния степень окисления выше, следовательно, центральным атомом является именно кремний, и именно его атомные орбитали участвуют в гибридизации.
2. Составим графическое изображение валентных электронов центрального атома.
Электронная формула атома кремния имеет следующий вид: 1s 22s 22p 63s 23p2. При затрате некоторой энергии (hυ) один из 3s-электронов атома кремния может быть переведен на
вакантную (свободную) 3р-орбиталь;

В образовании химических связей в атоме кремния участвуют электроны третьего внешнего энергетического уровня: один электрон в s- и три электрона в р-состояниях.
3. 
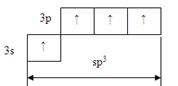 Определим число s -связей в молекуле SiCl 4 (число «периферийных» атомов, находящихся на связи с центральным). Четыре атома хлора (имеющих по 1 свободному электрону на внешнем уровне) образуют 4 s-связи с одним атомом кремния (имеющим 4 неспаренных электрона).
Определим число s -связей в молекуле SiCl 4 (число «периферийных» атомов, находящихся на связи с центральным). Четыре атома хлора (имеющих по 1 свободному электрону на внешнем уровне) образуют 4 s-связи с одним атомом кремния (имеющим 4 неспаренных электрона).
4. Определим тип гидридизации, помня, что в гибридизации участвуют только те валентные атомные орбитали, которые образуют s- связи, а также орбитали со спаренными электронами последнего энергетического уровня.
При образовании молекулы SiCl 4 возникает четыре гибридных атомных орбитали, расположенных в пространстве тетраэдрически.
Пример 4. Объясните закономерность увеличения температур кипения в ряду соединений NH3, HF, H2O.
В данном ряду между молекулами помимо вандерваальсовых сил действуют водородные связи, образованные между протоном Н+ и электроотрицательным элементов (N, F, O). Меньшую температуру кипения в аммиаке по сравнению с водой можно объяснить образованием менее прочных водородных связей, во-первых, азот, менее электроотрицателен, чем кислород, а во-вторых, в молекуле NH3 имеется только одна неподеленная пара электронов, способная оттягивать протон от соседней молекулы (помним, что кислород в молекуле воды имеет две неподеленные пары электронов).
Вместе с тем HF,тоже не столь прочно связан водородными связями, как H2O, не смотря на большую электротрицательность фтора по сравнению с кислородом и наличие у фтора трех неподеленных пар электронов. Дело в том, что молекула HF содержит один атом Н, который может использоваться для образования водородных связей.
Пример 5. Перечислите основные части комплексного соединения K4[Fe(CN)6]., определите заряд комплексообразователя и комплексного иона.
Внешняя сфера комплексного соединения K4[Fe(CN)6] состоит из четырех катионов калия (К+), следовательно, ее общий заряд будет составлять (+4). Отсюда следует, что заряд комплекса-аниона равен (-4),т.е. [Fe(CN)6] -4. Степень окисления в комплексообразователе рассчитывается следующим образом: -4 = х + 6 (-1); х = +2, т.е. Fe+2
Комплексообразователь - катион железа Fe+2; лиганды - CN- -ионы; комплекс (внутренняя сфера) [Fe(CN)6] -4, внешняя сфера – ионы калия К+, координационное число = 6.
Задания для самостоятельного решения
Задача 2.
1. покажите распределение валентных электронов по орбиталям для каждого атома в рассматриваемых молекулах;
2. определите механизм образования связи и ее вид;
3. определите полярность связи (для ответа рекомендуется использовать таблицу относительной электроотрицательности элементов);
4. укажите, имеет ли место гибридизация, ее тип;
5. покажите геометрическую структуру молекул (если это возможно);
6. определите полярность молекул.
| Номер варианта | Молекула | Номер варианта | Молекула | Номер варианта | Молекула |
| Н2S, TeF6 | Br2, SnH4 | NH3, HClO2 | |||
| AlBr3, H2Te | PF5, PbCl2 | BBr3, PbCl4 | |||
| GeH4, AsH3 | MgCl2, SF6 | I2, NiCl2 | |||
| GaI3, HCl | СF4, SO2 | SBr6, CS | |||
| BeBr2, SbBr3 | CO, BI3 | HCN, CS2 | |||
| SeF6, FeCl2 | HBr, SiF4 | NF3, CoCl2 | |||
| SClF5, LiH | AsF5, HNO3 | SbH3, CO2 | |||
| SiCl2, GaBr3 | GeCl2, SiO2 | PH3, GaI3 | |||
| PbCl4, HClO4 | SbCl5, SnH2 | OF2, BCl3 | |||
| SiCl4, H2SO4 | ССl4, H2O | PCl3O, BeH2 |
Задача 3.
| Номер варианта | Условие задачи |
| Температуры кипения НF, HCl, HBr, HI cсоответственно равны 292, 189, 206, 238 К. Объяснить почему температура кипения HF выпадает из общей закономерности галогеноводородов? | |
| Температуры кипения BF3, BCl3, BBr3 и BI3 соответственно равны 172, 286, 364, 483 K. Объяснить наблюдаемую закономерность. | |
| Объяснить, почему соединения меди (I) не окрашены, а соединения меди (II) — окрашены. | |
| Выберите из молекул H2O, H2S,HF, HCl те, для которых наиболее характерно образование водородной связи. Ответ поясните. | |
| Сероводород при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в свойствах? | |
| Полярность связи в молекуле HF больше, чем в молекуле HCl. Тем не менее в воде HCl более сильная кислота. Почему? | |
| Почему водородная связь оказывает влияние на свойства NH3, H2O и HF, но не оказывает заметного влияния на PH3, H2S и HCl? | |
| Почему бесцветны ионы Ag+ и Zn2+? Ответ пояснить. | |
| Какой вид межмолекулярного взаимодействия является универсальным и действует между любыми частицами? | |
| Номер варианта | Условие задачи |
| Приведите примеры катионных и анионных комплексов соединений (не менее 4), в которых комплексообразователь Cr+3, а координационное число 4 | |
| Как объяснить чрезвычайно большую растворимость в воде хлороводорода и аммиака – веществ со столь различной химической природой (при обычных условиях в 1 объеме воды растворяется 450 объемов HCl и 700 объемов NH3)? | |
| Чем отличаются температуры плавления веществ с различными кристаллическими решетками: а) атомной; б) ионной; в) молекулярной. Дайте пояснение. | |
| Из каких солей можно получить К3[Fe(CN)6]? Написать уравнение реакции. | |
| Из предложенных веществ (H2O, Cl2, He, NH3,CO2) выберите соединения, не способные к ориентационному и индукционному взаимодействию. Ответ поясните. | |
| Какова природа сил Ван-дер-Ваальса? Какой вид взаимодействия между частицами приводит к переходу в конденсированное состояние Ne, N2, HI, Cl2, BF3, H2O? | |
| Написать в молекулярной и ионно-молекулярной форме уравнение обменной реакции, происходящей между Na3[Co(CN)6] и FeSO4; имея в виду, что образующаяся комплексная соль нерастворима в воде. | |
| Объяснить неустойчивость гидроксидов меди (I) и серебра (I). | |
| Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Cu(NH3)4]SO4; K2[PtCl6]; K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах. | |
| Пользуясь таблицей констант нестойкости, расположить в порядке повышения устойчивости следующие ионы: [Cd(NH3)4]2+, [Cu(CN)4]2-, [Ag(NH3)2]+, [HgI4]2-. | |
| Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Ni(NH3)4]SO4; K3[Fe(CN)6]; K4[Fe(CN)6]. Напишите уравнения диссоциации этих солей в водных растворах. | |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости К2 [Sn(OH)4] | |
| Какое основание является более сильным: Cu(OH)2 или комплексное [Cu(NH3)4]? Почему? | |
| Написать в молекулярной и ионно-молекулярной форме уравнение обменной реакции, происходящей между: K4[Fe(CN)6] и CuSO4, имея в виду, что образующаяся комплексная соль нерастворима в воде | |
| Температуры кипения NF3, PF3 и AsF3 соответственно равны 144, 178, 336 K. Объяснить наблюдаемую закономерность. | |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости К3[Al(OH)6] | |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости (NH4)[PtCl6] | |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости H3[AuCl6] | |
| Номер варианта | Условие задачи |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости Na[Ag (NO2)2] | |
| K2CO3 плавится при 890ºС без разложения, Ag2CO3 разлагается уже при 220ºС. Объяснить указанное различие. | |
| Напишите название соединения, определите заряд комплекса и комплексообразователя, напишите схему диссоциации и выражение для константы нестойкости [Cr(H2O)6]Cl3 |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 8439; Нарушение авторских прав?; Мы поможем в написании вашей работы!