
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Окислительно-восстановительные реакции
|
|
|
|
Различают две группы химических реакций: реакции, протекающие без изменения степени окисления, и реакции, протекающие с изменением степени окисления атомов элементов. Реакции, идущие с изменением степени окисления, называют окислительно-восстановительными. Вещества, атомы или ионы которого повышают свою степень окисления, называются восстановителями. Вещества, атомы или ионы которого понижают свою степень окисления, называются окислителями. Окисление невозможно без протекающего одновременно с ним восстановления, и наоборот, восстановление одного вещества невозможно без одновременного окисления другого вещества.
Восстановителями могут быть: нейтральные атомы всех элементов, кроме фтора и некоторых инертных газов; атомы неметаллов в отрицательной степени окисления; атомы элементов в промежуточной положительной степени окисления.
Окислителями могут быть: нейтральные атомы неметаллов; атомы элементов в промежуточной положительной степени окисления; атомы элементов в высшей положительной степени окисления.
Для составления уравнений реакций окисления-восстановления необходимо знать формулы веществ, участвующих и получающихся в результате реакции. Используют два метода составления уравнений реакций окисления-восстановления: метод электронного баланса и метод ионно-электронный. Для удобства при составлении уравнений окислительно-восстановительных реакций принимают, что происходит не перераспределение электронной плотности, а прием и отдача электронов. В методе электронного баланса подсчет числа присоединенных и теряемых электронов производится на основании сравнения величин степеней окисления атомов элементов до и после реакции.
|
|
|
Пример 1. Составитьуравнение реакции между бромоводородом и концентрированным раствором серной кислоты. В результате реакции образуется свободный бром и оксид серы (IV).
1. Записываем схему реакции:
HBr + H2SO4 → Br2 + SO2
2. Определяем степень окисления атомов элементов до и после реакции. Выясняем, что произошло изменение степени окисления брома и серы:
HBr- + H2 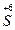 O4 →
O4 → 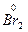 +
+  O2
O2
3. Составляем электронное уравнение:
 - 1
- 1  →
→ 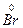
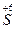 + 2
+ 2  →
→ 
4. Подбираем коэффициенты для окислителя и восстановителя. Так как общее число электронов, отданных восстановителем, должно быть равным числу электронов, принятых окислителем, то на каждый атом S+6 должно приходиться два иона брома Br-1


 - 1
- 1  →
→ 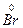 2
2
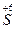 + 2
+ 2  →
→  1
1
5. Найденные коэффициенты подставляем в схему реакции:
2HBr + H2SO4 → Br2 + SO2
6. Сравнение обеих частей уравнения показывает, что в левой части находятся четыре атома водорода и два атома кислорода, которых нет в правой части уравнения.
Составляем уравнение реакции в окончательном виде:
2HBr + H2SO4 → Br2 + SO2 + 2Н2О
7. В заключении проверяем правильность уравнения, подсчитывая и сравнивая числа атомов кислорода в обеих частях уравнения.
При составлении уравнений окислительно-восстановительных реакций, протекающих в растворах, часто применяют ионно-электронный метод (метод полуреакций). В его основе лежит составление ионных уравнений для процесса окисления и процесса восстановления и последующее суммирование их в общее уравнение. при составлении ионной схемы используют правила составления кратких ионных уравнений: формулы сильных электролитов записывают в виде ионов, а слабых электролитов, осадков и газов – в виде молекул; ионы, не претерпевшие изменения в результате реакции, в схему не вносят.
Пример 2. Реакция окисления сульфита натрия с помощью перманганата калия выражается схемой:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
|
|
|
1. Составляем полное и краткое ионное уравнение, помня, что коэффициенты не подобраны.
 K++MnO4‾+2Na++SO32-+2H++SO42-→Mn2++SO42-+2Na++SO42-+2K++SO42-+H2O
K++MnO4‾+2Na++SO32-+2H++SO42-→Mn2++SO42-+2Na++SO42-+2K++SO42-+H2O
MnO4‾+SO32-+ 2H+ →Mn2++SO42-+H2O
2. Определяем среду раствора (ионы Н+ в кратком ионном уравнении, позволяют сделать вывод о наличии кислой среды)
3. Выписываем попарно частицы, изменившие свой состав или заряд.
MnO4‾ → Mn2+
SO32- → SO42-
4. В зависимости от среды раствора уравниваем число атомов каждого элемента в левой и правой частях схемы (в данном примере среда кислая)
   Среда раствора. Среда раствора.
| ||
| Кислая 1. В левой части схемы избыток кислорода в частице связываем ионами Н+ с образованием в правой части схемы молекул воды 2. Недостаток кислорода в левой части схемы берем из молекул воды с образованием ионов Н+ | Щелочная 1. В левой части схемы избыток кислорода связываем молекулами воды с образованием ионов ОН- в правой части схемы 2. В левой части схемы недостаток кислорода берем из ионов ОН- с образованием молекул воды | Нейтральная 1. В левой части схемы избыток кислорода связываем молекулами воды с образованием ионов ОН- 2. В левой части схемы недостаток кислорода берем из молекул воды с образованием ионов Н+ |
MnO4‾ + 8 H+ → Mn2+ + 4 H2O
SO32- + H2O → SO42- + 2 H+
5. Находим суммарный заряд частиц.
 MnO4‾ + 8 H+ → Mn2+ + 4 H2O
MnO4‾ + 8 H+ → Mn2+ + 4 H2O
 |  |

 SO32- + H2O → SO42- + 2 H+
SO32- + H2O → SO42- + 2 H+
 |  |
6. Уравниваем заряды в левой и правой частях схемы (если заряд увеличивается, то электроны вычитаем; если заряд уменьшается, то электроны прибавляем).
7. Находим Н.О.К.(наименьшее общее кратное) электронов и подбираем к ним дополнительные множители.
| Н.О.К | ||
| MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O | х 2 (восстановление, окислитель) | |
| SO32- + H2O - 2 ē → SO42- + 2 H+ | х 5 (окисление, восстановитель) |
8. Складываем левую часть схемы с левой, а правую с правой, учитывая дополнительные множители. Сокращаем одинаковые частицы в левой и правой частях.
2 MnO4‾ + 5 SO32 - + 16 H+ + 5 H2O → 2 Mn2+ +5 SO42-+ 8 H2O + 10 H+
9. Переносим коэффициенты в схему реакции (если для одного вещества два коэффициента, то переносим больший). Проверяем по кислороду правильность составления уравнения
2 KMnO4 + 5 Na2SO3 + 6 H2SO4 → 2 MnSO4 + 5 Na2SO4 + K2SO4 + 3 H2O
|
|
|
Задания для самостоятельного решения
Задача 7. Подберите коэффициенты электронно-ионным методом в предложенном уравнении, укажите окислитель и восстановитель.
| Номер варианта | Уравнение окислительно-восстановительной реакции |

| |
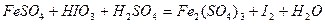
| |

| |

| |

| |
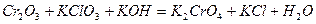
| |
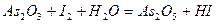
| |
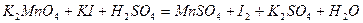
| |
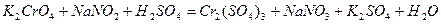
| |
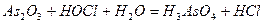
| |
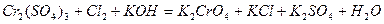
| |

| |
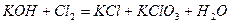
| |

| |
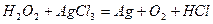
| |

| |
| Номер варианта | Уравнение окислительно-восстановительной реакции |

| |
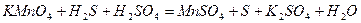
| |
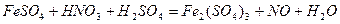
| |

| |
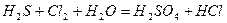
| |

| |
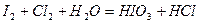
| |

| |

| |

| |

| |

| |
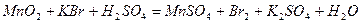
| |

|
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 884; Нарушение авторских прав?; Мы поможем в написании вашей работы!