
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Измерение ЭДС концентрационного элемента
|
|
|
|
Работа № 6
Цель: изучение работы и измерение ЭДС концентрационного гальванического элемента.
Задачи
1. Измерить ЭДС гальванического элементов с растворами сульфата меди разной концентрации;
2. Рассчитать теоретические значения ЭДС гальванического элемента и сравнить их с экспериментальными значениями.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
—центральный контроллер;
—модуль «Электрохимия» в комплекте с двумя стаканчиками (50 см3), датчиком температуры, медным и серебряным электродами и шнурами для подсоединения электродов;
2. Растворы cульфата меди разной концентрации.
Порядок выполнения работы
1) Приготовить растворы сульфата меди (II) с концентрацией 1.0 М, 0.1 М и 0.01 М, согласно методике приготовления растворов.
Методика приготовления растворов
Приготовить из 1 М раствора сульфата меди/железа (II) путем последовательного разбавления 2 раствора с концентраций 0.1 М и 0.01 М.
1) Наливают в две колбы 100 мл дистиллированной воды.
2) В первую колбу переносят 10 мл исходного раствора и тщательно перемешивают. В первой колбе концентрация раствора соли составит 0.1 М.
3) Из первой колбы во вторую переносят 10 мл раствора соли. Содержимое колбы перемешивают. Во второй колбе концентрация раствора соли составит 0.01 М.
2) Собрать концентрационный гальванический элемент и измерить его ЭДС
a) Два медных электрода зачистить наждачной бумагой и промыть дистиллированной водой.
b) Один стеклянный cтаканчик заполнить 1 М раствором сульфата меди (II), второй стеклянный стаканчик - 0.1 М раствором сульфата меди (II).
c) Поместить электроды в стеклянные стаканчики, заполненные растворами.
|
|
|
d) Для обеспечения электролитического контакта между исследуемыми электродами помещаем в стеклянные стаканчики солевой мостик.
3. Подключение электродов и термодатчика производят согласно электрической схеме.
4. Измерения ЭДС гальванического элемента повторить для 0.1 М и 0.01 М раствора сульфата меди (II).
5. Рассчитать теоретические значения для потенциалов медного jCu2+/Cu электродов для разных концентраций сульфата меди (II), воспользовавшись уравнением Нернста и значениями стандартных потенциалов, приведенных в таблице.
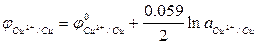
6. Рассчитать теоретического значение ЭДС гальванического элемента Eтеор.
7. Определить относительную погрешность эксперимента по формуле
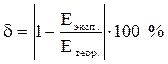
8. Полученные данные занести в табл. 1.
Таблица 1
| [CuSO4], моль/л | Eэксп., мВ | jCu2+/Cu, мВ | Eтеор., мВ | d, % |
| 1.0 | ||||
| 0.1 | ||||
| 0,01 |
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
2. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) СuSО4; б) МgSО4;
в) Рb(NО3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
3. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0.015 В меньше его стандартного электродного потенциала? Ответ: 0.30 моль/л.
4. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNO3; б) ZnSО4; в) NiSО4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
5. Марганцевый электрод в растворе его соли имеет потенциал – 1.23 В. Вычислите концентрацию ионов Мn2+ (в моль/л). Ответ: 1.89 • 10-2 моль/л.
|
|
|
6. Потенциал серебряного электрода в растворе АgNО3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/ л)? Ответ: 0.20 моль/л.
7. Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС медно-кадмиевого гальванического элемента, в котором концентрации [Сd2+] =0.8 моль/л, а [Сu2+] =0.01 моль/л. Ответ: 0.68 В.
8. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
9. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1.89·10-12 моль/ л.
10. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0.01 N, а второй в 0.1 N растворы АgNО3. Ответ: 0.059 В.
11. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0.001 М растворе, а другой такой же электрод - в 0.01 М растворе сульфата никеля. Ответ: 0.0295 В.
12. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0.01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2.244В.
13. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
14. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
|
|
|
15. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, в растворы своих солей с концентрацией [Мg2+] = [Сd2+] = 1 моль/ л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0.01 моль/л? Ответ: 1.967 В.
16. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если концентрация [Zn2+] = 0.001моль/л? Ответ: 7.3•10-15 моль/л.
17. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Ni + Pb (NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0.01 моль/л, [Pb2+] = 0.0001 моль/л. Ответ: 0.064 В.
18. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
19. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
20. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1442; Нарушение авторских прав?; Мы поможем в написании вашей работы!