
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярно-кинетическая теория идеальных газов
|
|
|
|
●Закон Бойля-Мариотта
 при
при 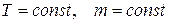 ,
,
где p – давление; V – объем; Т – термодинамическая температура; m – масса газа.
● Закон Гей-Люссака и закон Шарля
 , или
, или 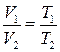 при
при  ;
;
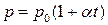 , или
, или  при
при 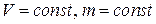 ,
,
где t – температура по шкале Цельсия; 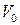 и
и 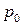 - соответственно объем и давление при 00 С; коэффициент
- соответственно объем и давление при 00 С; коэффициент 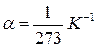 ; индексы 1 и 2 относятся к произвольным состояниям.
; индексы 1 и 2 относятся к произвольным состояниям.
● Закон Дальтона для давления смеси n идеальных газов
 ,
,
где 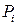 - парциальное давление i – го компонента смеси.
- парциальное давление i – го компонента смеси.
● Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
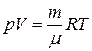 ,
,
где  – газовая постоянная, μ – молярная масса газа.
– газовая постоянная, μ – молярная масса газа.
● Зависимость давления газа от концентрации n молекул и температуры Т
 ,
,
где  – постоянная Больцмана (k=R/Na,
– постоянная Больцмана (k=R/Na,  – постоянная Авогадро).
– постоянная Авогадро).
● Основное уравнение молекулярно-кинетической теории идеальных газов
 ,
,
или
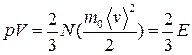 ,
,
или
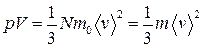 ,
,
где 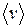 - средняя квадратичная скорость молекул; Е- суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул;
- средняя квадратичная скорость молекул; Е- суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул; 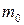 - масса одной молекулы;
- масса одной молекулы;  - масса газа; N- число молекул в объеме газа V.
- масса газа; N- число молекул в объеме газа V.
● Скорость молекул:
наиболее вероятная
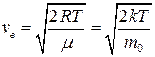 ;
;
средняя квадратичная
 ;
;
средняя арифметическая
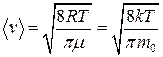 .
.
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
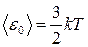 .
.
● Закон Максвелла для распределения молекул идеального газа по скоростям
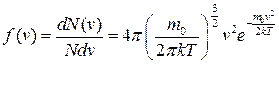 ,
,
где функция 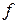 (
(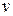 ) распределения молекул по скоростям определяет относительное число молекул
) распределения молекул по скоростям определяет относительное число молекул 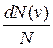 из общего числа N молекул, скорости которых лежат в интервале от
из общего числа N молекул, скорости которых лежат в интервале от 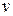 до
до 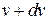 .
.
● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
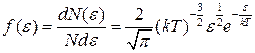 ,
,
где функция f(ε) распределения молекул по энергиям теплового движения определяет относительное число молекул  из общего числа N молекул, которые имеют кинетические энергии
из общего числа N молекул, которые имеют кинетические энергии  , заключенные в интервале от ε до ε+dε.
, заключенные в интервале от ε до ε+dε.
|
|
|
● Барометрическая формула
 ,
,
где  и
и 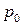 – давление газа на высоте h и h0.
– давление газа на высоте h и h0.
● Распределение Больцмана во внешнем потенциальном поле
 ,
,
где n и n0 – концентрация молекул на высоте h и h0.
● Среднее число соударений, испытываемых молекулой газа за 1 секунду,
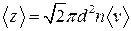 ,
,
где d –эффективный диаметр молекулы; n – концентрация молекул; 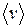 - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
● Средняя длина свободного пробега молекул газа
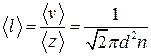 .
.
● закон теплопроводности Фурье
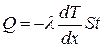 ,
,
где Q теплота, прошедшая посредством теплопроводности через площадь S за время t;  - градиент температуры; λ- теплопроводность:
- градиент температуры; λ- теплопроводность:
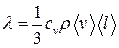 ,
,
где сv – удельная теплоемкость газа при постоянном объеме; ρ- плотность газа.
● Закон диффузии Фика
 ,
,
где М – масса вещества, переносимая посредством диффузии через площадь S за время t; 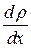 - градиент плотности, D – диффузия:
- градиент плотности, D – диффузия:
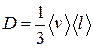 .
.
● Закон Ньютона для внутреннего трения (вязкости)
 ,
,
где F – сила внутреннего трения между движущимися слоями площадью S;
 - градиент скорости; η – динамическая вязкость:
- градиент скорости; η – динамическая вязкость:
 .
.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 386; Нарушение авторских прав?; Мы поможем в написании вашей работы!