
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородная межмолекулярная связь
|
|
|
|
Донорно-акцепторное взаимодействие молекул
происходит при наличии у атома одной молекулы – неподеленной пары ē, а у атома другой молекулы – свободной АО: KF + BF3 → K[BF4]
В молекуле KF неподеленная пара ē: F-… 2s22p6 (F- донор)
В молекуле BF3свободная АО: B*…2s12p2 (B* акцептор)
Между этими молекулами возникает ковалентная связь по донорно-акцепторному механизму.
это связь, образованная положительно поляризованным атомом водорода одной молекулы - А-Н и электроотрицательным атомом В - другой молекулы
Межмолекулярная Н-связь: А- – Н+ + В- – R ® А- – Н+... В- – R
водородная связь
Атомы А и В – одинаковые: Нd+- Fd- + Нd+- Fd- ® H-F... H-F
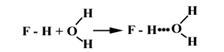 |
Атомы А и В – разные:
Признак водородной связи: расстояние между ядром Н и ядром атома В меньше, чем это расстояние при вандерваальсовом взаимодействии. Наиболее прочные связи с элементами II периода: - Н... F- > -Н... O= > -Н... N≡
Энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовыми силами.
Возникновение водородных связей приводит к ассоциации молекул: к образованию димеров, тримеров и других полимерных структур, зигзагообразных структур (НF)n, спиральных структур белков, кристаллического строения льда, кольцевой димерной структуры низших карбоновых кислот и др. Межмолекулярные Н-связи изменяют свойства веществ: повышают вязкость, диэлектрическую постоянную, температуру кипения и плавления, теплоту плавления и парообразования вещества: Н2О, НF и NН3 - аномально высокие Ткип и Тпл.
ПРИМЕР. Чем Вы объясните более высокую температуру кипения NH3 по сравнению с PH3?
Обе молекулы – полярны. Между молекулами РН3 – вандерваальсовы взаимодействия, а в системе, состоящей из молекул NH3 кроме вандерваальсовых взаимодействий присутствуют межмолекулярные водородные связи, следовательно, для фазового перехода NH3 нужно приложить больше энергии и ТкипNH3 выше.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!