
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газовые законы. Уравнение Менделеева-Клапейрона
|
|
|
|
Экспериментальное исследование свойств газов, проведенное в ХVII-XVIII вв. Р. Бойлем (1627-1691 гг.), Э. Мариоттом (1620-1684 гг.), Ж. Гей-Люссаком (1778-1850 гг.) и Ж. Шарлем привело к формулировке газовых законов:
1. Изотермический процесс - t=const
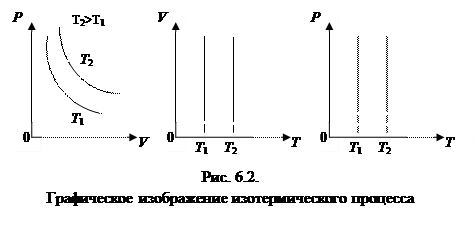 |
Закон Бойля-Мариотта: для данной массы газа, при постоянной температуре, произведение давления газа на объем остается величиной постоянной, то есть при T = const и m = const (см. рис. 6.2):
| P×V = const | (6.5.1,а) |
или
| P 1 ×V 1 = P 2 ×V 2. | (6.5.1,б) |
2. Изобарный процесс - p=const.
Закон Гей - Люссака: для данной массы газа, при постоянном давлении, объем линейно возрастает с увеличением температуры, то есть при р = const и m = const (см. рис. 6.3):
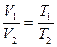
| (6.5.2,а) |
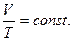
| (6.5.2,б) |
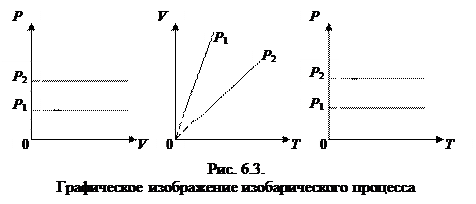 |
или
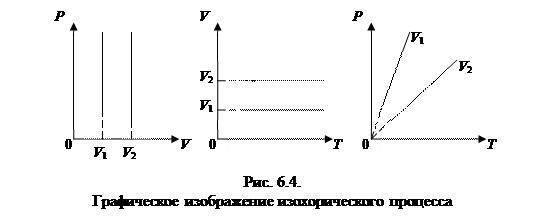
3. Изохорический процесс - V=const.
Закон Шарля: для данной массы газа, при постоянном объеме, давление линейно возрастает с увеличением температуры, то есть при V = const и m = const (см. рис. 6.4):

| (6.5.3,а) |
или
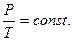
| (6.5.3,б) |
 |
Комбинируя выражения газовых законов, получим уравнение, связывающее р, V, Т (объединенный газовый закон):
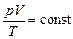 .
.
Постоянная в этом уравнении определяется экспериментально. Для 1 моль газа она оказалась равной R=8,31 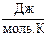 и была названа универсальной газовой постоянной.
и была названа универсальной газовой постоянной.
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде массой 0,012 кг. Число молекул (структурных единиц) в 1 моле равно числу Авогадро: NA=6,02·1023моль-1. Для газовой постоянной R справедливо соотношение: R= k NA
Итак, для одного моля: 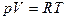 .
.
Для произвольного количества газа n = m/ m (уравнение Менделеева-Клапейрона): 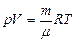 ,
,
где m - молярная масса газа.
Установим связь между уравнение кинетической теории газов и уравнением Менделеева-Клапейрона. 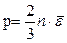
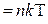 ,
, 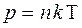 .
.
|
|
|
Так как n =N/V, то  . Для количества вещества справедливо соотношение
. Для количества вещества справедливо соотношение 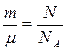 , а для постоянной Больцмана – k = R / NA, поэтому последнее уравнение можно записать в виде:
, а для постоянной Больцмана – k = R / NA, поэтому последнее уравнение можно записать в виде:
 или
или 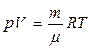 .
.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!