
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 6. Константа равновесия КР для реакции I2 2I при t1 = 677°C равна 1,149 × 102, а при t2 = 777°C 7,413 × 102
|
|
|
|
Константа равновесия КР для реакции I2  2I при t1 = 677°C равна 1,149 × 102, а при t2 = 777°C 7,413 × 102. Определить тепловой эффект реакции.
2I при t1 = 677°C равна 1,149 × 102, а при t2 = 777°C 7,413 × 102. Определить тепловой эффект реакции.
| DНр° -? | Cu | Для решения задачи используем уравнение изобары
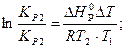 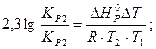 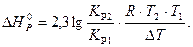 DH = 2,3lg ((7,413×102×8,314×1050×950)/(1,149×102(-100))) = 154600 Дж/моль = 154,6 кДж/моль.
DH = 2,3lg ((7,413×102×8,314×1050×950)/(1,149×102(-100))) = 154600 Дж/моль = 154,6 кДж/моль.
|
| t1 = 677°C t2 = 777°C KP1 = 1,149×102 KP2 = 7,413×102 | 950K 1050K |
Вопросы для самоконтроля
1) Назовите признаки химического равновесия
2) Приведите примеры обратимых и необратимых реакций
3) Что понимают под термином химическое сродство
4) Перечислите условия, которые необходимо создать для большего выхода продуктов реакции: СН4(г) + Н2О(г)  СО(г) + 3Н2(г) + Q
СО(г) + 3Н2(г) + Q
Тема 1.6. Фазовое равновесие
Фазовыми равновесиями называются гетерогенные равновесия, то есть состояния, при которых переход веществ из одной фазы в другую не сопровождается изменением их химического состава (кристаллизация, парообразования и т.д.)
Американский учёный Гиббс вывел правило фаз, которое устанавливает при каких условиях (t°, P, C) отдельные однородные участки гетерогенных систем (фазы) находятся в состоянии термодинамического равновесия.
С + Ф = Кn + n.
Ф – число фаз – совокупность гомогенных частей системы, обладающих одинаковыми термодинамическими свойствами и которые отделены от других частей системы видимыми поверхностями раздела.
Кn – число независимых компонентов – минимальное число компонентов, достаточное для построения любой фазовой системы.
Для физических систем (системы, в которых происходят фазовые превращения, не химические). Кn = K
K – число компонентов в системе (химических соединений).
Для химических систем (системы, в которых протекают химические реакции).
|
|
|
Кn = K минус число химических реакций.
С – число степеней свободы – это наибольшее число факторов (t°, P, C), которое можно произвольно менять без числа фаз в системе (фазовых равновесий).
n – число внешних факторов
С + Ф = Кn + 2 (для неконденсированных систем)
С + Ф = Кn + 1 (для конденсированных систем)
При изучении гетерогенных равновесий используют фазовые диаграммы – диаграммы состояния системы и фазовых равновесий в ней в зависимости от внешних условий (t°, P) или от состава системы.
Диаграммы состояния строятся в масштабе по экспериментальным данным и позволяет определить состояние системы при любых заданных условиях.
Примеры решения задач.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 751; Нарушение авторских прав?; Мы поможем в написании вашей работы!