
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам
|
|
|
|
При рассмотрении первого начала термодинамики важной методической задачей является раскрытие физического содержания термодинамических понятий - внутренняя энергия, работа, количество теплоты.
С точки зрения молекулярной теории внутренняя энергия представляет собой энергию всех частиц, составляющих систему, то есть в нее входит кинетическая и потенциальная энергия всех структурных элементов системы. Во внутреннюю энергию не входит кинетическая энергия движения системы как целого и потенциальная энергия системы во внешнем силовом поле.
Следует обратить внимание, что при изучении каких-либо процессов, происходящих в системе, нас интересует не полный запас внутренней энергии, а лишь ее изменение. В тепловых процессах, протекающих при температурах среднего интервала, под изменением внутренней энергии следует понимать изменение кинетической и потенциальной энергии молекул, поскольку остальные составляющие внутренней энергии не изменяются.


Естественно, что если система совершила круговой процесс, то ее конечное состояние совпадает с начальным. Очевидно, что изменение внутренней энергии системы в таком процессе равно нулю.
Для идеального газа (приняли, что взаимодействием молекул и атомов в ТД системе пренебрегаем) внутренняя энергия определяется лишь суммой кинетических энергий хаотического движения молекул.




Макроскопическая система, находящаяся в состоянии термодинамического равновесия, может изменять свое состояние только в результате внешних воздействий. С макроскопической точки зрения существуют два принципиально различных способа изменения состояния системы в результате внешних воздействий:
|
|
|
1) путем обмена частью внутренней энергии между рассматриваемой системой и другими внешними системами-телами и этот способ изменения состояния системы связан результатом контакта двух различно нагретых тел, когда изменение состояния теплового движения происходит вследствие соударений частиц на границе соприкосновения и при этом никаких макроскопических перемещений не происходит.
2) путем совершения работы над системой или самой системой. Второй способ всегда связан с изменением относительного расположения системы и взаимодействующих с ней внешних тел, а следовательно, связан с совершением работы.
Два рассмотренных способа сводятся к работе и теплообмену, которые представляют собой две единственно возможные формы передачи энергии.
Понятие работы.
- 1) работа является мерой изменения энергии, перешедшей из одного вида в другой;
- 2) работа зависит от способа перехода ТД системы из одного состояния в другое, то есть является функцией процесса;
- 3) элементарная работа измеряется величиной pd
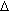 V. В общем, при переходе ТДсистемы из состояния 1 в состояние 2
V. В общем, при переходе ТДсистемы из состояния 1 в состояние 2  ;
; - 4) для вычисления работы необходимо знать уравнение процесса;
- 5) в координатах p, V работа изображается площадью под кривой процесса;
- 6) при замкнутом процессе работа не равна нулю, несмотря на то, что система вернулась в исходное состояние.
Понятие "количество теплоты".
Если одно тело имеет более высокую температуру, чем другое, то первое будет передавать часть своей внутренней энергии второму путем молекулярных столкновений. Предположим, что работа при этом не совершается. В этом случае принято говорить, что первое тело передало второму некоторое количество теплоты. Очевидно, что количество теплоты в данном случае равно уменьшению внутренней энергии первого тела или увеличению внутренней энергии второго тела. Количество теплоты при теплообмене тела с окружающей средой характеризует количество энергии, передаваемое тепловым способом. Понятно, что количество теплоты зависит от условий, в которых происходит теплопередача, последнее означает, что количество теплоты является функцией процесса.
|
|
|
Очень важно предостеречься от ошибки смешивать понятия количества теплоты и энергии хаотического теплового движения, составляющей часть внутренней энергии. Нельзя говорить о количестве теплоты, содержащемся в теле, а можно говорить только о количестве теплоты в процессе теплопередачи. Следует обратить внимание на то, что в общем случае количество теплоты не представляет собой меру приращения или убыли внутренней энергии. Это определение относится лишь к случаю, когда передача внутренней энергии не сопровождается совершением работы.
После рассмотрения основных понятий и экспериментальных результатов следует сформулировать первое начало термодинамики как универсальный закон сохранения и превращения энергии, подчеркивая при этом не только его опытный характер, но и образец глубокого теоретического обобщения. Современная наука принимает принцип сохранения и превращения энергии как всеобщий, выполняющийся абсолютно строго для всех изолированных систем.
Необходимо обратить внимание на то, что при описании процессов, происходящих в термодинамических системах с использованием первого начала термодинамики, следует определиться с правилом знаков. Это дело договоренности. Но целесообразно пользоваться общепринятым правилом: работа считается положительной, если она совершается системой, и отрицательной, если она совершается над системой. Количество теплоты положительно, если система получает его в процессе теплопередачи, и отрицательно, если оно передается внешним телам.
Для последующего описания изопроцессов в идеальном газе с использованием первого начала термодинамики следует ввести понятие теплоемкости, показать, что эта характеристика системы зависит от условий процесса, ввести понятие изобарной, изохорной теплоемкости, установить соотношение между ними, вскрыть физический смысл универсальной газовой постоянной. Имеет смысл обратить внимание на соотношение между молярной и удельной теплоемкостями.
|
|
|








Результаты применения первого начала термодинамики к описанию простейших процессов в идеальном газе целесообразно представить в виде таблицы (приложение 2), содержащей следующие графы:
- 1) название и условия протекания процесса;
- 2) уравнение процесса;
- 3) графическое представление процесса;
- 4) значение всех величин, входящих в первое начало термодинамики применительно к рассматриваемому процессу;
- 5) значение теплоемкости в данном процессе;
- 6) значение показателя политропы.
Последующее использование этой таблицы значительно облегчит решение конкретных физических задач на практических занятиях.

|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1320; Нарушение авторских прав?; Мы поможем в написании вашей работы!