
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На аноде
На катоде
ü в первую очередь восстанавливаются наиболее сильные окислители, т.е. идет реакция с более + Е
ü если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
При электролизе окислители делятся на три группы:

Потенциал водорода зависит от рН (уравнение Нернста)
Правила анодного окисления
ü в первую очередь окисляются наиболее сильные восстановители, т.е. идет реакция, потенциал которой наименьший
ü если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
Ионы SO42-, NO3-, NO2-, CO32-, PO43- (анионы кислородсодержащих кислот) в водных растворах на аноде не окисляются.
Задача 4.
Электролиз раствора Na2SO4, электроды Pt – инертные (не активные)
Решение
Ионный состав раствора:
Na2SO4 ® 2Na+(р) + SO42-(р) т.к. гидролиза нет рН = 7
Н2Ож  Н+(р) + ОН-(р)
Н+(р) + ОН-(р)
- К Na+(р), Н+(р)
Е0 Na+/Na=-2,7В, ЕН+/Н2= -0,059рН= -0,413В
+А SO42-(р), ОН-(р)
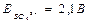 , EО2 /OH-=1,227-0,059pH=0,814 B
, EО2 /OH-=1,227-0,059pH=0,814 B
 2,1
2,1
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е 0,81
Sр-ция: 2Н2О ® 2Н2 + О2 Umin
-0,41
-2,7
Задача 5.
Электролиз Н2О (электроды Pt – инертные, сам металл не окисляется)
Решение.
Н2Ож  Н+р + ОН-р рН = 7
Н+р + ОН-р рН = 7
(-) К: 2Н+р + 2е ® Н2
(+)А: 4ОН-р ® О2 + 2Н2О+4е
 2Н2Ож ® 2Н2 + О2
2Н2Ож ® 2Н2 + О2
ЕН+/Н2 = -0,059рН = -0,414 В ЕО2/ОН- =1,23 – 0,059рН = 1.23 – 0,414 = 0,816 В
 Е, В
Е, В
0,816
Umin
-0,414
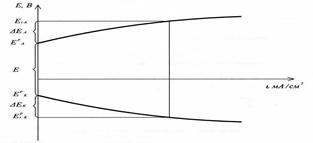 Umin = ЕО2/ОН- - ЕН+/Н2 =1,23 В. Под током потенциалы изменяютcя – поляризация:
Umin = ЕО2/ОН- - ЕН+/Н2 =1,23 В. Под током потенциалы изменяютcя – поляризация:
Поляризационные кривые при электролизе

U - напряжение, которое необходимо подать на электроды от внешнего источника постоянного тока;
DЕом = r .I - омическое падение напряжения на внутреннем сопротивлении электрохимической цепи (r)
U – можно снизить:
1) уменьшить rвнутр.: уменьшить расстояние между электродами, применяя добавки повышающие эл/проводность электролита;
2) уменьшить поляризацию: увеличить Sэлектродов – сделать более пористой, перемешивать, уменьшить силу тока, увеличить Т.
Если при электролизе на электродах протекает не один, а несколько процессов, то доля общего количества электричества (в%), расходуемая на превращение одного из веществ, называется выходом по току этого вещества (Вi) 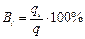
qi – кол-во электричества, пошедшее на превращение i вещества
q – общее кол-во электричества, прошедшее через электрод
Задача 6.
Рассмотреть электролиз раствора Na2SO4 на растворимых Ni-электродах. Напишите уравнения процессов электролиза.Покажите ход поляризационных кривых. Рассчитайте массы и объемы выделившихся газов (приведенные к н.у.), которые образуются на электродах за 0,2 часа при токе 5А. В i (О2)=60%.
Решение.
Ионный состав раствора:
Na2SO4 ж → 2Na+p + SO42-p
Н2Ож ↔ Н+р + ОН-р
(соль образована сильным основанием и сильной кислотой, нет гидролиза)
рН = 7
Равновесные потенциалы возможных электродных процессов:
[- K]: Е0Na+/ Na = - 2,9В ЕрН+/Н2 = -0,059рН = -0,41В
[+A]: SO42- - не окисляется, ЕрО2/ОН- =1,23-0,059рН=0,82В
Е0Ni2+/ Ni = - 0,025В Þ ∆E < 1 Þ два процесса
[- K]: 2Н+ + 2е → Н2↑ 100%
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е 60%
Ni0 → Ni2+ + 2e 40%
По закону Фарадея
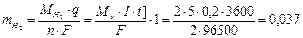 г
г 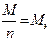
 г
г
При н.у. V0m = 22,4 л/моль, 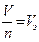 , моль/л
, моль/л
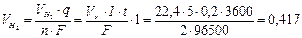 л
л
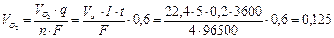 л
л
Задача 7
Написать электродные процессы электролиза водного раствора CuCl2 на Сгр электродах. Показать ход поляризационных кривых. Рассчитать массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2. Определить выход по току Cl2 и О2.
Решение.
Ионный состав раствора:

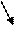 CuCl2 → Cu2+ + 2Cl- H2O
CuCl2 → Cu2+ + 2Cl- H2O  H+ + OH-.
H+ + OH-.
слабое сильная Þ рН» 5
основание кислота
- К Cu2+, H+
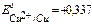 B,
B,  B,
B, 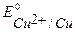 >
> 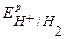 , Þ восстановление Сu2+
, Þ восстановление Сu2+
+ А 2Cl- , OH-
 В,
В,  В,
В,
∆ Е =  -
-  < 1 В Þ из-за поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки Þ будет окисление ОН- и Cl–
< 1 В Þ из-за поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки Þ будет окисление ОН- и Cl–
- K: Cu2+ + 2  → Cu
→ Cu
+A: 4ОН- → O2 + 2H2О + 4 
2Cl- → Cl2 + 2  .
.
 Поляризационные кривые CuCl2 на С (графитовых) электродах
Поляризационные кривые CuCl2 на С (графитовых) электродах
Масса меди, образовавшаяся на катоде:  qK = qA qA = qO2 + qCl2
qK = qA qA = qO2 + qCl2
Обьем моль эквивалентов газов при н.у.:
 ,
, 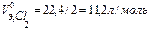
По закону Фарадея:
5,6 л/моль О2 - 96500 А×с qО2 = 96,5 А×с
5,6×10-3л О2 - qО2
11,2 л/моль Cl2 – 96500 А×с qCl2 = 48,25 A×c
5,6×10-3моль Cl2 - qCl2

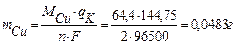
выход по току:
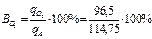 =66%,
=66%,  =34 %.
=34 %.
Задача 8.
Как изменится процесс электролиза водного раствора CuCl2 при замене электродов C на Cu.
Решение.
Ионный состав раствора – без изменения
на катоде: тот же процесс: Cu2+ + 2  → Cu
→ Cu
на аноде:  В,
В,
 В,
В,
материала анода -  В.
В.
 <
<  и
и 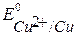 <
<  Þ на аноде в первую очередь - окисление Cu- электрода.
Þ на аноде в первую очередь - окисление Cu- электрода.
-K: Cu2+ + 2  → Cu
→ Cu
+A: Cu → Cu2+ + 2  .
.
При больших напряжениях U электролизера могут быть достигнуты  ,
,  и
и 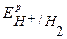
Поляризационные кривые

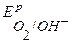
Применение электролиза
Металлургия
Гальванотехника
ЭХОМ
Размерная обработка
Анодирование
Химическая промышленность
1. Гальванотехника включает гальваностегию и гальванопластику.
А) Гальваностегия – нанесение металлических покрытий на поверхность изделия путем электролиза. Электролит – водный раствор соли металла, который наносят.

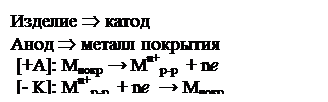
|
|
Гальваническая ванна
Назначение гальванических покрытий:
· Защита от коррозии
· Защитно-декоративное
· Повышение электропроводности
· Повышение твердости и износостойкости
· Получение магнитных пленок
· Уменьшение коэффициента трения
· Улучшение способности к пайке
· Улучшение отражательной способности поверхности
В) Гальванопластика – получение тонкостенных изделий сложной формы путем электролиза (в приборостроении на основу наносят металл малой толщины путем электролиза, а затем химически растворяют основу - алюминиевые конденсаторы)
К: Аl3++3e =Al
Задача 9.
Рассчитайте толщину никелевого покрытия на стальном изделии поверхностью 1 м2 и изменение толщины Ni анода поверхностью 1 м2 при э/х никелировании в течение 1 ч из водного раствора на основе NiSO4, если катодная плотность тока – 100 А/м2, а анодная – 50 А/м2. Выход по току Ni на катоде – 0,8, а на аноде – 0,9. Плотность Ni ρ=8,9 г/см3. (Гидролизом пренебречь, рН=7).
Решение.
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
[- K]: Ni2+ + 2e → Ni
2Н+ + 2е → Н2↑
[+A, Ni]: Ni → Ni2+ + 2e
4ОН- → О2 ↑ + 2Н2О + 4е
По закону Фарадея на катоде: 
Толщина Ni покрытия на изделии:  (9,84 мкм)
(9,84 мкм)
Масса растворившегося никелевого анода:

Изменение толщины Ni анода: 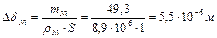 =5,5 мкм
=5,5 мкм
|
|
Дата добавления: 2014-11-18; Просмотров: 680; Нарушение авторских прав?; Мы поможем в написании вашей работы!