
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз в металлургии
|
|
|
|
 А) Рафинирование
А) Рафинирование

Электролизер для рафинирования
Задача 10.
Основной М – Со; примеси – Zn и Cu. Как провести очистку в растворе H2SO4?
Решение.
Ионный состав раствора:
H2SO4 → 2 H+ + SO42-
H2O ↔ H+ + OH- рН=1
На аноде: SO42-, OH-, Со, Zn, Cu
Выписываем все потенциалы:
ЕрН+/Н2= -0,059рН = -0,059 В (т.к. рН=1)
ЕрО2/ОН- =1,23-0,059рН = +1,17В;
Е0Co2+/Co = - 0,277В
Е0Zn2+/Zn = -0,76В;
Е0Сu2+/Cu = + 0,337В
Þ [+A]: Zn0 → Zn2+ + 2е (в первую очередь, т.к. Е0Zn2+/Zn< Е0Co2+/Co)
Co0 → Co2+ + 2е
Cu не растворяется и выпадает в шлам
На катоде: H+; Co2+; Zn2+
[- K]: 2Н+ + 2е → Н2↑ (сначала, пока ССо2+ = 0 моль/л)
Cо2+ + 2е → Cо0
а ионы Zn2+ остались в растворе (подбор i).Так получают очень чистые М.
Задача 11.
Рассмотрите процесс рафинирования Ni, содержащего примеси Zn и Cu в растворе H2SO4. Какие процессы будут протекать на катоде и аноде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение.
Ионный состав раствора:
H2SO4 → 2 H+ + SO42-
H2O ↔ H+ + OH- рН=2
Запишем потенциалы возможных электродных процессов
ЕрО2/ОН- =1,23-0,059рН = +1,112В, ЕрН+/Н2 = -0,059рН = -0,118В
Е0Ni2+/Ni = - 0,250 В
Е0Zn2+/Zn = -0,76 В;
Е0Сu2+/Cu = + 0,337В
Т.к.Е0Zn2+/Zn < Е0Ni2+/Ni < Е0Cu2+/Cu < EpO2/OH - то первым на аноде окисляется Zn, затем очищаемый М – Ni, примеси Cu не растворяются, а выпадают в осадок (шлам).
Т.к. Е0 Ni2+/Ni > Е0Zn2+/Zn и концентрация ионов Ni2+ ↑, чем ионов Zn2+, то на катоде осаждается чистый никель.
В начале процесса в растворе отсутствуют ионы Ni2+ и на катоде выделяется Н2.
[+A]: Zn0 → Zn2+ + 2е
Ni0 → Ni2+ + 2е
[- K]: 2Н+ + 2е → Н2↑
Ni2+ + 2е → Ni0
Время для рафинирования по закону Фараде (Мэ,Ni=29,5 г/моль) 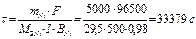 или τ= 9,27ч
или τ= 9,27ч
В) Получение металлов
Из расплава – Mg, Na, Li, Be, Ca, Al (Аl из расплава минерала криолит Na3AlF3).
Из водных растворов – ост. цветные, рассеян. и благ.металлы
|
|
|
К: Al3+ + 3e = Al К: Сu2+ + 2e = Cu
3. ЭХОМ – электрохимическая обработка металлов.
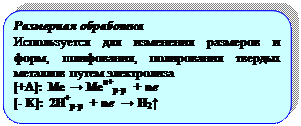 |  | ||
А) Инструмент – КАТОД, заготовка (титан, тантал, молибден, ванадий) – АНОД; между ними прокачивается электролит (растворы кислот, щелочей)
В) При анодировании Аl: Аl – 3e =Al3+
2Al3+ +3/2O2 = Al2 O3
4. Химическая промышленность (важные химические вещества: Н2, О2, F2, органические вещества, окислители …)
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 523; Нарушение авторских прав?; Мы поможем в написании вашей работы!