
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 9. Комплексные соединения кобальта и никеля
К осадку гидроксида никеля (III), полученному в опыте 11, прибавить несколько капель разбавленного раствора соляной кислоты. Над отверстием пробирки подержать фильтровальную бумагу, смоченную раствором йодида калия.
Опыт 8. Свойства гидроксида никеля (III) (показательный)
- Отметить, какие изменения происходят в пробирке ………………
………………………………….на фильтровальной бумаге………………
- Составить уравнение реакции, учитывая, что одним из продуктов реакции является Cl2.
Ni(OH)3 + HCl → …
- как изменилась степень окисления хлора ………………, никеля…………………
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях…
- Ni(OH)3 проявляет …………………… свойства
- Вывод
а) Аквакомплекс кобальта (II) и его разрушение
В пробирку поместить 4 - 5 капель насыщенного раствора соли кобальта (II) и добавить несколько капель концентрированной хлороводородной кислоты (плотность 1,19 г/см3) Прибавить к раствору 7 - 8 капель воды до нового изменения окраски.
- Отметить, какие изменения происходят в пробирке
- Изменение цвета раствора объясняется тем, что непрочный комплексный ион [Со(Н2О)6]2+, имеющий розовую окраску, может превращаться в хлоридный комплекс [СоCl4]2-. В растворе устанавливается равновесие:
[Со(Н2О)6]2+ + 4Cl- 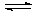 [СоCl4]2- + 6H2O
[СоCl4]2- + 6H2O
- при добавлении избытка соляной кислоты равновесие смещается в направлении………………, при добавлении воды - …………………..
- Вывод
б) Получение аммиакатных комплексов кобальта
В две пробирки внести по 2 - 3 капли раствора соли кобальта (II) и прибавить по каплям концентрированный раствор аммиака до выпадения осадка гидроксида кобальта (II) и его дальнейшего растворения вследствие образования комплексного соединения. Одну из пробирок несколько раз встряхнуть до изменения окраски от зеленоватой до желто-коричневой. Во вторую пробирку добавить 2 - 3 капли 3%-ного раствора пероксида водорода.
- Отметить, какие изменения происходят в пробирках
- Составить уравнение реакции образования осадка гидроксида кобальта (II) при действии недостатка аммиака:
CoCl2 + NH4OH ®
- Составить уравнение реакции растворения осадка гидроксида кобальта (II) при действии избытка аммиака и образования аммиакатного комплекса кобальта (II):
Co(OH)2 + 6NH4OH ® [Co(NH3)6](OH)2 + 6H2O
- Составить уравнение реакции окисления полученного комплексного соединения кобальта (II) в комплексное соединение кобальта (III) кислородом воздуха:
[Co(NH3)6](OH)2 + O2 + H2O ® [Co(NH3)6](OH)3
- Составить уравнение реакции окисления полученного комплексного соединения кобальта (II) пероксидом водорода с образованием аммиакатного комплекса кобальта (III):
[Co(NH3)6](OH)2 + H2O2 ® [Co(NH3)6](OH)3
- Используя данные диаграммы Латимера, объясните, почему аммиакатный комплексный ион Со(II) окисляется кислородом воздуха, тогда как аквакомплекс Со(II) - [Со(Н2О)6]2+ - удается окислить лишь пероксидом водорода
- Составить уравнения диссоциации полученных комплексных соединений:
[Co(NH3)6](OH)2 ®
[Co(NH3)6](OH)3 ®
- диссоциации комплексных ионов и выражения констант их нестойкости
[Co(NH3)6]2+ 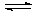 K нест [Co(NH3)6]2+ =
K нест [Co(NH3)6]2+ =
[Co(NH3)6]3+ 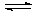 K нест [Co(NH3)6]3+ =
K нест [Co(NH3)6]3+ =
- Укажите по величине константы нестойкости, какой комплексный ион прочнее:
K нест [Co(NH3)6]2+ = K нест [Co(NH3)6]3+ =
- сравните координационные формулы комплексных соединений кобальта в разных степенях окисления, и укажите их пространственную конфигурацию:
[Co(NH3)6]2+ [Co(NH3)6]3+
в) Получение аммиакатного комплекса никеля(II)
|
|
Дата добавления: 2014-11-18; Просмотров: 3936; Нарушение авторских прав?; Мы поможем в написании вашей работы!