
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 2. Растворимость и кислотно-основные свойства оксида хрома (III)
|
|
|
|
Опыт 1. Получение соединений хрома (II) и изучение их свойств
а) Внести в пробирку около I мл раствора хлорида хрома (III), несколько капель концентрированной HCl и одну гранулу металлического цинка.
- Отметить изменение окраски раствора…
- Составить уравнение реакции
Zn + HCl →
CrCl3 + H2 →
б) В пробирку налить часть полученного в опыте 1а раствора хрома (II).
- Отметить изменение окраски раствора при взбалтывании ………….
- Составить уравнение реакции
CrCl2 + O2 + HCl →
- рассчитать ЭДС реакции: ЭДС = φок. – φвос.
- можно ли использовать подкисленный раствор CrCl2 для поглощения кислорода в растворе………..
в) В пробирку с раствором щелочи добавить раствор хлорида хрома (II), полученный в опыте 1а. Смесь взболтать.
- Охарактеризовать внешний вид осадка гидроксида хрома (II)
- Составить уравнение реакции
CrCl2 + NaOH →
- объяснить изменение окраски осадка гидроксида хрома (II) при стоянии на воздухе
- Составить уравнение реакции
Cr(OH)2 + O2 + H2O →
Вывод:
В три пробирки поместить по 1 микрошпателю образовавшегося (опыт 2) оксида хрома (III). В 1-ю пробирку прилить дистиллированной воды, во 2-ю - раствор соляной кислоты, в 3-ю – раствор гидроксида натрия.
- Отметить изменение окраски растворов и
растворимость оксида хрома (III) в воде ………
растворимость оксида хрома (III) в кислоте ………
растворимость оксида хрома (III) в щелочи………
- составить уравнения реакций:
Cr2O3 + HCl 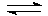 …
…
Cr2O3 + NaOH + H2O  …
…
- сделать вывод о свойствах оксида хрома (III).
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 994; Нарушение авторских прав?; Мы поможем в написании вашей работы!