
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмотическое давление
Осмос - самопроизвольный переход молекул растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией.
Осмотическое давление p - это минимальное давление, которое нужно приложить к раствору, чтобы остановить осмос.
↓ π
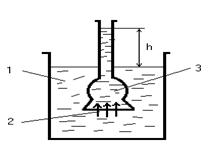 Мембрана пропускает только молекулы растворителя. М олекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (h).
Мембрана пропускает только молекулы растворителя. М олекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (h).
С1< С3
Обратный осмос – если внешнее давление, приложенное к более концентрированному раствору, выше осмотического, Р > p, то молекулы растворителя будут переходить из концентрированного раствора в разбавленный раствор (или чистый растворитель) т.к. скорость перехода молекул растворителя из концентрированного раствора будет больше. (Используется для очистки природных и сточных вод, для получения питьевой воды из морской воды).
Уравнение Вант Гоффа: p = СRT
где p - осмотическое давление, кПа;
С - молярная концентрация раствора, моль/л (1 Дж/л = 1 кПа)
R = 8,3 Дж/(моль К) -универсальная газовая постоянная.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. В биологических процессах осмос обеспечивает поступление воды в клетки и регулирует обменные процессы.
Активность
Законы Рауля и Вант-Гоффа строго соблюдаются - в разбавленных растворах неэлектролитов. При п овышении концентрации возрастают отклонения. Причина - взаимодействия между частицами растворенного вещества, а также растворенного вещества и растворителя. Выход – в формулыдля описания свойств реальных растворов вместо входящих в них концентраций компонентов подставляют активности.
Активность а связана с концентрацией С: а =g С, где g - коэффициент активности (безразмерная величина), формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора: 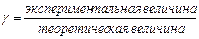
g - вычисляют по экспериментальным данным как частное от деления экспериментально полученной величины (температуры кипения, замерзания и др.) на теоретически рассчитанную по законам идеальных растворов для данной концентрации; g -.
|
|
Дата добавления: 2014-11-18; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!