
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа №1. Рис. 27. Оборудование для изучения субстратной специфичности амилазы
|
|
|
|
ИЗУЧЕНИЕ СУБСТРАТНОЙ СПЕЦИФИЧНОСТИ АМИЛАЗЫ.
Рис. 27. Оборудование для изучения субстратной специфичности амилазы
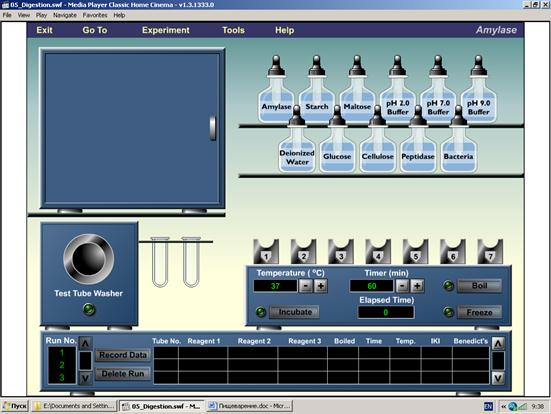
Амилаза слюны является гликолитическим ферментом, основные субстраты которого – полисахариды крахмал и гликоген. Наиболее эффективен он при температуре 37-380С и слабощелочной среде (рН 8).
Цель эксперимента: продемонстрировать субстратную специфичность амилазы слюны и выявить оптимальные условия для ее работы.
Принцип действий: амилазу смешивают с тремя углеводами, которые обладают разной структурой. Для выявления моносахаридов используется реакция Бенедикта, реактив IKI, содержащий йод, используется для выявления в растворах полисахаров (крахмала).
В набор реактивов на полке входят:
1) ферменты: амилаза (Amylase), крахмал (Starch), пептизаза (Peptidase), бактерии (Bacteria);
2) субстраты: мальтоза (Maltose), дистиллированная вода (Deionized water), глюкоза (Glucose), целлюлоза (Cellulose),
3) три буферных раствора с рН 2, pH 7 и pH 9.
Вы имеет возможность поместить три раствора (по одному из каждой группы) в пробирку, которая извлекаются из держателя и помещается в инкубатор. Число проб может быть от 1 до 7. Основное правило: в каждой пробирке должно быть смешано три раствора.
Составьте план эксперимента: какие субстраты и какие ферменты Вы будете смешивать, и при какой величине рН. Например:
Пробирка 1. Крахмал + амилаза + рН 9;
Пробирка 2. Глюкоза + амилаза + рН 9;
Пробирка 3. Целлюлоза + амилаза + рН 9;
Пробирка 4. Целлюлоза + бактерии + рН 7;
Пробирка 5. Крахмал + пептидаза + рН 2;
Пробирка 6. Мальтоза + амилаза + рН 9
Пробирка 7. Крахмал + вода + рН 7;
Алгоритм действий:
1. Установите время инкубации (по умолчанию оно составляет 60 мин). Если Вы хотите исследовать влияние времени инкубации на гидролиз субстратов – измените его так, как Вам нужно.
|
|
|
2. С помощью мышки захватите 1-ю пробирку из контейнера и поместите на штатив инкубатора. С помощью пипетки наполните ее субстратом (крахмалом), добавьте фермент (амилазу) и буфер с рН = 9 (вспомните, что наибольшую активность амилаза проявляет в щелочной среде).
3. Захватите 2-ю пробирку из контейнера и поместите ее в штатив. Наполните ее растворами в соответствии с Вашим планом эксперимента.
4. Повторяйте эти шаги, пока не заполните все места в штативе.
5. Нажмите кнопку Incubate для начала инкубации растворов в термостате. После окончания выставленного времени пробирки появятся из термостата, и откроется штатив с контрольными реактивами.
6. С помощью мышки захватите первую пробирку и отлейте из нее часть раствора в первую пробирку в контрольном штативе. Повторите это для каждой следующей пробирки.
7. В каждую контрольную пробирку добавьте с помощью мышки по капле реактива IKI, который содержит йод. Почернение раствора в пробирке укажет на присутствие в нем полисахарида (крахмала).
8. Добавьте по капле реактива Бенедикта (Benedict) в каждую из пробирок, находящихся в штативе инкубатора. Затем включите кипячение (кнопка «Boil» справа от указателя времени).
Возможные всплывающие подсказки при нарушении технологии эксперимента:
Before boiling, a test tube must be filled with the correct number of reagents and lowered into the incubation unit (Перед кипением, испытательная труба должна быть заполнена правильным числом реактивов и подвергнута инкубации)
The following test tubes do not contain the proper number of reagents (Следующие испытательные трубы не содержат надлежащее количество реактивов)
Benedict’s solution has already been dispensed to this tube (Реактив Бенедикта был уже добавлен в эту трубу)
Изменение окраски раствора укажет на наличие в нем моносахарида (глюкозы). Нажмите «Record date» для регистрации результатов эксперимента. Перепишите эти данные в тетрадь и сделайте вывод о субстратной специфичности амилазы и влиянии на ее активность рН и времени инкубации.
|
|
|
Таблица 1. Субстратная специфичность амилазы
| № пробирки | Субстрат | Фермент | рН | время | ТоС | Наличие крахмала | Наличие глюкозы |
1) На какие субстраты воздействует амилаза лучше всего?
2) Где расщепляется целлюлоза и под влиянием каких ферментов?
3) Каков оптимум рН для работы амилолитических ферментов?
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 791; Нарушение авторских прав?; Мы поможем в написании вашей работы!