
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинаміка реакцій утворення і дисоціації оксидів заліза
|
|
|
|
Послідовність дисоціації за наявності декількох оксидів або утворення оксидів або інших з'єднань підкоряється принципу послідовності перетворень А. А. Байкова, по якому хімічні перетворення здійснюються послідовно, скачками через хімічні сполуки, існуючі в даній системі, тобто від вищого оксиду до нижчого через проміжні сполуки. Наприклад, для заліза ряд послідовної дисоціації виглядає так: Fe2O3 ® Fe3O4 ® FеО, для марганцю МnO2 ® Mn2O3 ® Mn3O4® MnO.
У природі існує три оксиди заліза Fe2O3 – гематит, Fе3O4 – магнетит і оксид змінного складу – вюстит, що умовно позначається як FeO.
Дисоціація оксидів заліза при t > 570°С протікає по наступних реакціях:
2FeO = 2Fe + O2; (2.1)
6Fe2O3 = 4Fе3О4 + O2; (2.2)
2Fe3O4 = 6FeO + O2; (2.3)
при t < 570°С, де FeO нестійкий, реакції (2.1) і (2.3) не здійснюється, йде реакція
Fe3O4 = 3/2 Fe + O2; (2.4)
При високих температурах оксид Fe2O3 не стійкий і може розпадатися.
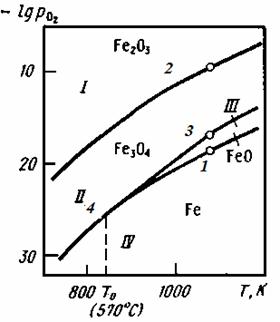
На рис. 2.4 показані залежності логарифма пружності дисоціації оксидів заліза від температури.
|
| Рис. 2.4 - Залежність температури на пружність дисоціації оксидів заліза |
Цифри у кривих відповідають реакціям (2.1), (2.2), (2.3), (2.4). При t > 570°С  <
< 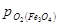 оксид – FeO міцніший, ніж Fe3O4. При 570 0С
оксид – FeO міцніший, ніж Fe3O4. При 570 0С  =
= 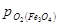 оксиди мають однакову міцність. При цій температурі в рівновазі знаходяться 4 фази: Fe3O4 – FeO – Fe – O2. Система нонваріантна. По цій діаграмі можливо встановити області існування конденсуючих фаз.
оксиди мають однакову міцність. При цій температурі в рівновазі знаходяться 4 фази: Fe3O4 – FeO – Fe – O2. Система нонваріантна. По цій діаграмі можливо встановити області існування конденсуючих фаз.
Область I – це область стійкого існування Fe2O3, тут 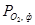 >
> 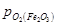 >
> 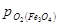 >
> 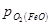 . При такому парціальному тиску кисню залізо, вюстіт і магнетит повинні окислюватися до Fe2O3.
. При такому парціальному тиску кисню залізо, вюстіт і магнетит повинні окислюватися до Fe2O3.
Область II – область стійкого існування Fе3O4. Тут 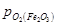 >
> 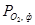 >
>  >
> 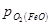 . Оксид Fe2O3 повинен дисоціювати до Fе3O4, а FеO або залізо окислюватися до Fe3O4.
. Оксид Fe2O3 повинен дисоціювати до Fе3O4, а FеO або залізо окислюватися до Fe3O4.
Область III характеризує стійкий стан FеO, 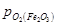 >
>  >
> 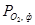 >
>  . У цій області Fe2O3 і Fе3О4 відновлюються до FеО, а металево залізо окислюється до FeO. Область IV – стійкий стан Fe.
. У цій області Fe2O3 і Fе3О4 відновлюються до FеО, а металево залізо окислюється до FeO. Область IV – стійкий стан Fe.
|
|
|
Діаграма стану залізо–кисень
Фазовий склад системи залізо-кисень визначають за допомогою діаграми стану. В цій двокомпонентній системі може одночасно існувати не більше чотирьох фаз, що відповідає нонваріантності системи: С = 2 – 4 + 2 = 0 або Ф = К + 2 = 4. Три фази є конденсуючими. В числі фаз, які конденсують можуть бути: тверді розчини кисню в a-Fe, g-Fe, d-Fe; вюстит, магнетит a- і g-Fe2О3, тверді і рідкі розчини оксидів. Діаграма стану представлена на рис. 2.5. Ліва частина діаграми до розриву має концентрації кисню від 0 до 0,2%, права – від 22 до 31%.

|
| Рис. 2. 5 - Діаграма стану залізо-кисень |
Розглянемо області існування різних фаз.
I – область твердого розчину кисню в a-Fe + O2;
II – область твердого розчину кисню в g-Fe + O2;
III – область твердого розчину кисню в d-Fe + O2;
IV – область трифазного співіснування: твердого розчину кисню в a-Fe + магнетиту + O2.
V – область трифазної рівноваги: твердий розчин кисню в a-Fe, вюстит з мінімальним вмістом кисню + O2:
VI – область трифазної рівноваги: твердий розчин кисню в g-Fe + вюстит з мінімальним вмістом кисню + O2;
VII – область твердого насиченого розчину кисню в g-Fe + шлаковий розплав + O2;
VIII – твердий насичений розчин кисню в d-Fe + шлаковий розплав + O2;
IX – ненасичений розчин кисню в рідкому залізі + O2;
X – область вюститу із змінною концентрацією кисню + O2;
XI – область шлакових розплавів + O2;
XII – трифазна область: вюстит з максимальним вмістом кисню + магнетит + O2;
XIII – шлаковий розплав + магнетит + O2;
XIV – трифазна область – до 1100°С магнетит + гематит + O2; вище 1100°С – твердий розчин гематиту в магнетиті + гематит + О2; склад змінний, кисню міститься більше, ніж в Fe3O4;
XV – твердий розчин гематиту в магнетиті + O2;
XVI – гематит + O2;
XVII – твердий розчин гематиту в магнетиті + O2.
Магнетит зберігає постійний склад до 1100°С, а вищі за цю температуру склад магнетиту буде змінним з надмірним проти стехіометричного вмісту кисню. Магнетит плавиться при 1597 0С..
|
|
|
Розглянемо процес кристалізації рідкого заліза, що містить 0,22% кисню, відзначивши, що гранична розчинність кисню в залізі при 1600°С рівна 0,23%. В крапці 1 повинна утворюватися плівка шлаку – оксидна фаза – рідкий розплав, що відповідає складу 1¢ та містить 22,2 % кисню. Нижче за температуру крапки 1 склад металу змінюється по лінії 1 – 2¢, а склад шлаку – по лінії 1 - 2¢¢. Досягши 1528°С починається кристалізація насиченого твердого розчину кисню в d-Fe (чисте залізо кристалізується при 1540°С).
Гранична розчинність кисню d-Fe складає приблизно 0,04%, крапка 2¢¢¢. В крапці 2¢ знаходитимуться в рівновазі чотири фази: d-Fe складу 2¢¢¢, розплав заліза складу 2¢, шлаковий розплав складу 2¢¢ і О2. При подальшому пониженні температуру склад твердого розчину кисню змінюється по лінії 2¢¢¢ - 3¢, а склад шлаку – по лінії 2¢¢ – 3¢¢. При температурі 1400°С d-Fe перетворюється в g-Fe. При температурі 1370°С шлаковий розплав кристалізується – утворюється вюстит складу крапки 4¢¢¢ і твердий розчин кисню в g-Fe складу крапки 4¢.
Надалі всі перетворення відбуваються тільки з участю твердих фаз. При 910°С g-Fe перетворюється в a-Fe, вірніше, розчин кисню в g-Fe + вюстит в твердий розчин кисню в a-Fe. При 570°С вюстит розпадається на твердий розчин кисню в залізі і на магнетит. Повна діаграма стану Fe – О є побудовою в трьох координатах: температура – склад фази, яка конденсує – рівноважний тиск кисню. Розглянемо перетворення в системі при постійній температурі – процес ізотермічного окислення. Проведемо ізотермічний розріз системи Fe – О при 1200°С. Розріз приведений на рис. 2.6. Цей розріз показує залежність lg 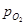 від вмісту кисню в фазах, які конденсують.
від вмісту кисню в фазах, які конденсують.
Окисленню g-Fe на діаграмі відповідає переміщення від крапки а до б; концентрація кисню в твердому g-Fe зростає, росте і lg 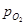 . Від крапки б до в (див. рис. 2.6) відбувається кількісна зміна співвідношення двох фаз g-Fe, FeO, склад твердих фаз не змінюється.
. Від крапки б до в (див. рис. 2.6) відбувається кількісна зміна співвідношення двох фаз g-Fe, FeO, склад твердих фаз не змінюється.
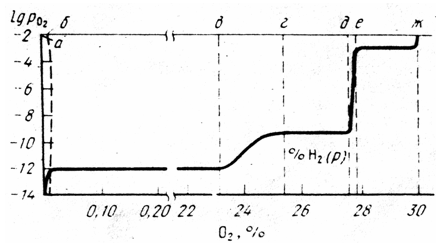
| Рис. 2.6 – Ізотермічний розріз діаграми стану залізо-кисень при температурі 1200 0С |
Сумарний вміст кисню в суміші зростає. Рівноважний же тиск 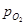 залишається незмінним – це пружність дисоціації FeO складу крапки в. Між крапками в і г відбувається зміна складу вюститу; вміст кисню в ньому збільшується і відповідно росте lg
залишається незмінним – це пружність дисоціації FeO складу крапки в. Між крапками в і г відбувається зміна складу вюститу; вміст кисню в ньому збільшується і відповідно росте lg 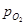 . Між точками г і д знову маємо постійні склади фаз і постійну величину lg
. Між точками г і д знову маємо постійні склади фаз і постійну величину lg 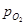 – пружність дисоціації Fe3O4. Між крапками д і е відбувається зміна складу магнетиту; вміст кисню в ньому збільшується і відповідно росте lg
– пружність дисоціації Fe3O4. Між крапками д і е відбувається зміна складу магнетиту; вміст кисню в ньому збільшується і відповідно росте lg 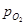 . На ділянці між точками е – ж знову маємо постійні склади фаз і постійну величину lg
. На ділянці між точками е – ж знову маємо постійні склади фаз і постійну величину lg 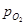 – пружність дисоціації Fe2O3. Горизонтальні ділянки відповідають гетерогенним областям з фазами постійного складу, похилі ділянки відповідають двофазним областям із змінним складом фаз за вмістом кисню.
– пружність дисоціації Fe2O3. Горизонтальні ділянки відповідають гетерогенним областям з фазами постійного складу, похилі ділянки відповідають двофазним областям із змінним складом фаз за вмістом кисню.
|
|
|
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 624; Нарушение авторских прав?; Мы поможем в написании вашей работы!