
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинаміка гомогенного горіння
|
|
|
|
Система С-Н-О
Система Н-О
Система С-О
1. Реакція повного горіння вуглецю С +О2 = СО2 + Q
2. Реакція неповного горіння вуглецю С +1/2О2 = СО + Q
3. Реакція догорання СО до СО2 СО +1/2О2 = СО2 + Q
4. Реакція газифікації С газом СО2 С +СО2 = 2СО – Q
5. реакція повного горіння водню Н2 +1/2О2 = Н2Ог + Q
6. Реакція газифікації С газом Н2О до СО С + Н2О = Н2 + СО – Q
7. Реакція газифікації С газом Н2О до СО2 С + 2Н2О = 2Н2 + СО2 – Q
8. Реакція водяного газу Н2Ог + СО = СО2 + Н2 + Q
Горіння водню (реакція 5)
Реакція горіння Н2 описується рівнянням
2Н2 + O2 = 2Н2Oг + Q; Δ G 0 = - 492230 + 108,24· Т;
 або, якщо виразити концентрації в газовій фазі в об'ємних %,
або, якщо виразити концентрації в газовій фазі в об'ємних %,  .
.
Число ступенів свободи реакції (5) за правилом фаз Гіббса С = К– Ф + 2, С=2 – 1 + 2= 3. Рівноважний стан системи визначається трьома незалежними змінними: температурою, тиском і концентрацією в газовій фазі.
Залежність константи рівноваги реакції (5) від температури визначається рівнянням 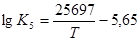 .
.
При підвищенні загального тиску газів і пониження температури в системі рівновага в системі зміщується у бік утворення водяної пари.
Горіння оксиду вуглецю (II) СО (реакція 3)
Реакція горіння СО описується рівнянням:
2СО + О2 = 2СО2 + Q; Δ G 0 = - 565390 + 175,17· Т.
Реакція екзотермічна. Константа рівноваги реакції (3) рівна 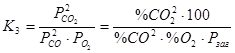 . По правилу фаз Гіббса число ступенів свободи для цієї системи складає: С = 2 – 1 + 2 = 3.
. По правилу фаз Гіббса число ступенів свободи для цієї системи складає: С = 2 – 1 + 2 = 3.
Залежність константи рівноваги від температури визначається рівнянням  .
.
З підвищенням температури рівновага реакції (3) зміщується в праву сторону.
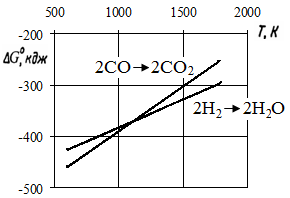
|
| Рис. 3.1 - Залежність DG0 від температури реакцій горіння Н2 (5) і СО (3) |
По термодинамічних особливостях реакції (5) і (3) багато в чому аналогічні. На рис. 3.1 представлена зміна 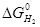 і
і  залежно від температури. Можна наголосити на двох областях: а) до точки перетину прямих, тобто до 1083 К (810 °С)
залежно від температури. Можна наголосити на двох областях: а) до точки перетину прямих, тобто до 1083 К (810 °С) 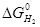 >
>  (спорідненість СО до кисню вище, ніж у Н2, а значить, і відновна здатність вища); б) при Т > 1083 К
(спорідненість СО до кисню вище, ніж у Н2, а значить, і відновна здатність вища); б) при Т > 1083 К 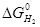 <
<  (спорідненість до кисню і відновні здібності вищі у водню). При Т = 1083 К Н2 і СО мають рівну відновну здібність і спорідненість до кисню.
(спорідненість до кисню і відновні здібності вищі у водню). При Т = 1083 К Н2 і СО мають рівну відновну здібність і спорідненість до кисню.
|
|
|
Взаємодія водяної пари з монооксидом вуглецю. Реакція водяного газу (реакція 8)
Реакцією водяного газу називається реакція взаємодії
H2O + СО = Н2 + СO2; Δ G 0 = - 36580 + 33,46· Т.
Реакція слабкоекзотермічна. Константа рівноваги даної реакції рівна  .
.
За правилом фаз Гіббса число ступенів свободи визначається з рівняння: С=3 – 1 + 2 = 4, тобто рівноважний стан характеризується 4-мя незалежними змінними: температурою і концентраціями трьох компонентів (Н2O – вважаємо газом).
За законом Гесса термодинамічні функції реакції (8) можуть бути одержані підсумовуванням реакцій (5) і (3)
(3) СО + 1/2О2 = СО2
-
 (5) Н2 + 1/2О2 = Н2О
(5) Н2 + 1/2О2 = Н2О
(8) Н2О + СО = СО2 + Н2
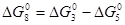 ; K8 = K3/K5
; K8 = K3/K5
Залежність константи рівноваги від температури визначається рівнянням:  . При 1083 К величина К 5 = К 3, отже, К 8 = 1, а
. При 1083 К величина К 5 = К 3, отже, К 8 = 1, а  =0. Реакція водяного газу обратима. При Т >1083 К водень володіє великою спорідненістю до кисню, ніж СО, рівновага реакції повинна зміщуватися вліво; при Т< 1083 К рівновага зміщується вправо, оскільки СО володіє великою спорідненістю до кисню, а СО2 міцніший, ніж Н2О.
=0. Реакція водяного газу обратима. При Т >1083 К водень володіє великою спорідненістю до кисню, ніж СО, рівновага реакції повинна зміщуватися вліво; при Т< 1083 К рівновага зміщується вправо, оскільки СО володіє великою спорідненістю до кисню, а СО2 міцніший, ніж Н2О.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 459; Нарушение авторских прав?; Мы поможем в написании вашей работы!