
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газифікація вуглецю водяною парою
Взаємодію водяної пари з вуглецем можна представити у вигляді наступних співвідношень
реакція 6 С + Н2О = СО + Н2 – Q Δ G 0 = 135550 - 143,99· Т.
реакція 7 С + 2Н2О = СО2 + 2Н2- Q Δ G 0 = 98970 - 110,53· Т.
Реакції (6) і (7) ендотермічні і за принципом Ле-Шателье з підвищенням температури їх рівновага зміщується управо, у бік зменшення рівноважного вмісту водяної пари. Процеси (6) і (7) супроводжуються збільшенням об'єму та із зменшенням тиску рівноважна концентрація Н2О падатиме. Величини констант рівноваги записуються таким чином:
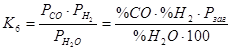 ;
;  .
.
Термодинамічні параметри процесів взаємодії водяної пари з вуглецем доцільно одержувати за даними супутніх їм перетворень (4) і (8), користуючись непрямим методом розрахунку:
(4) С + СО2 = 2СО (4) С + СО2 = 2СО
- -
(8) СО2 + Н2 = СО + Н2О (8) 2×(СО2 + Н2 = СО + Н2О)
(6) С + Н2О = СО + Н2 (7) С + 2Н2О = СО2 + 2Н2
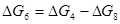 ;
; 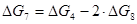 ;
;  ;
;  .
.
Залежності констант рівноваги реакцій (6) і (7) від температури мають вигляд 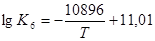 ;
;  . У системі, що складається з вуглецю і водяної пари, обидві реакції (6) і (7) протікають паралельно, причому переважний розвиток однієї з них залежить від температури. При підвищенні температури стійкість СО в газовій фазі стає вище, ніж СО2 і тому вихід реакції (6) збільшується, вона одержує більший розвиток, ніж реакція (7).
. У системі, що складається з вуглецю і водяної пари, обидві реакції (6) і (7) протікають паралельно, причому переважний розвиток однієї з них залежить від температури. При підвищенні температури стійкість СО в газовій фазі стає вище, ніж СО2 і тому вихід реакції (6) збільшується, вона одержує більший розвиток, ніж реакція (7).
|
|
Дата добавления: 2014-11-20; Просмотров: 396; Нарушение авторских прав?; Мы поможем в написании вашей работы!