
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения состава раствора
|
|
|
|
Вопросы к семинару
1. Определение моля и эквивалента. Как рассчитать фактор эквивалентности?
2. Закон Авогадро. Мольная масса и мольный объем вещества и его эквивалентов. Для каких соединений они имеют переменные значения? Закон эквивалентов.
3. Как найти практически 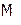 и
и 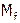 . Формула Клапейрона-Менделеева.
. Формула Клапейрона-Менделеева.
4. При каких условиях реальные газы можно рассматривать как идеальные?
5. Сколько атомов в моле вещества? а молекул в 100 мл воды при 40С?
6. Решить каждому студенту одну из следующих задач по [6] (№10 и №11), (с №1 по №9), (с №12 по №16).
Состав раствора выражают разными способами: в массовых, объемных или молярных долях, или указывая его молярную концентрацию и др. [8].
Массовая доля соединения ( ) показывает, какую часть (т.е. долю) от массы всей системы, состоящей из k компонентов, составляет масса данного вещества.
) показывает, какую часть (т.е. долю) от массы всей системы, состоящей из k компонентов, составляет масса данного вещества.
Объемная доля соединения ( ) используется для газообразных систем и равна отношению объема данного газа к объему всей системы, состоящей из k газов.
) используется для газообразных систем и равна отношению объема данного газа к объему всей системы, состоящей из k газов.
Молярная доля вещества (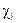 ) равна отношению количества данного соединения к числу молей всей системы, содержащей k компонентов.
) равна отношению количества данного соединения к числу молей всей системы, содержащей k компонентов.
Доли рассчитывают по соответствующим формулам:
 ,
, 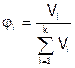 ,
, 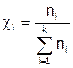 .
.
Молярная концентрация показывает количество растворенного вещества, которое находится в 1л раствора. Ее обозначение – C. Например, запись  моль/л означает, что в 1 л раствора – одна десятая моля хлороводорода; а
моль/л означает, что в 1 л раствора – одна десятая моля хлороводорода; а  моль указывает на то, что 1 л раствора содержит 1 моль эквивалентов перманганата калия, то есть
моль указывает на то, что 1 л раствора содержит 1 моль эквивалентов перманганата калия, то есть  или 0,2 моль его.
или 0,2 моль его.
Возможна и другая запись молярной концентрации, например: 0,1М НСl – децимолярный раствор; или  , т.е.
, т.е.  – это двунормальный раствор. (Если молярная концентрация выражена через моли эквивалентов, то обозначается Сf и при ее названии используется термин «нормальная».)
– это двунормальный раствор. (Если молярная концентрация выражена через моли эквивалентов, то обозначается Сf и при ее названии используется термин «нормальная».)
|
|
|
Молярная концентрация раствора, который приготовлен из навески растворенного вещества m (г) в мерной колбе объема V (мл), рассчитывается по формуле:  . (Для расчета Сf вместо М подставляют
. (Для расчета Сf вместо М подставляют 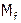 ).
).
Рассмотрим на конкретных примерах, как осуществляется переход от одного способа выражения концентрации раствора к другому.
Пример 1. Определить массовую долю азотной кислоты в 12M ее растворе, плотность которого (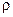 ) равна 1,33 г/мл.
) равна 1,33 г/мл.
Массовая доля кислоты определяется формулой: 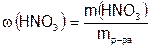 .
.
Масса 1 л 12M раствора кислоты равна:  г;
г;
а масса растворенного вещества:  .
.
Следовательно, 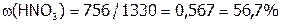 , а
, а 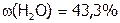 .
.
Пример 2. Рассчитать молярную и нормальную концентрации фосфорной кислоты с массовой долей кислоты в растворе 3% (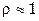 г/мл).
г/мл).
Искомые концентрации определяются формулами: 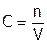 и
и 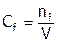 .
.
Если взять 100 г раствора, указанного в задаче, то получим:
 ,
, 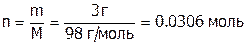 . И тогда:
. И тогда: 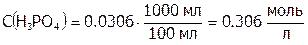 , а
, а 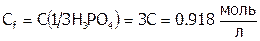 .
.
ЛАБОРАТОРНАЯ РАБОТА «Приготовление растворов»
(Приготовленные растворы обязательно сдавать препаратору!)
1. Приготовление раствора заданного состава. Определить состав концентрированной серной кислоты, имеющейся в лаборатории, с помощью ареометра и, проведя необходимые расчеты, приготовить из нее 100 мл раствора с массовой долей кислоты, указанной преподавателем. В присутствии препаратора измерить плотность полученного раствора и сравнить ее значение с представленным в табл. 8. Рассчитать ошибку определения. Чем она может быть вызвана?
2. Определение влажности воздушно-сухой соли. Исходя из точной навески дихромата калия, указанной преподавателем по таблице 9, приготовить 100 мл раствора. Измерить его плотность в присутствии препаратора и рассчитать влажность исходной соли. Пример расчета: пусть приготовили 100мл раствора из 8,7г K2Cr2O7. Его плотность – 1,0533г/мл, значит, m(раствора) = 105,53г, а  (K2Cr2O7) = 7,986% (находим по табл. 8 интерполяцией). То есть m(сухой соли) =105,53г* 7,986% = 8,4276, следовательно, влажность соли: (8,7–8,4276)/8,7=3,1%.
(K2Cr2O7) = 7,986% (находим по табл. 8 интерполяцией). То есть m(сухой соли) =105,53г* 7,986% = 8,4276, следовательно, влажность соли: (8,7–8,4276)/8,7=3,1%.
|
|
|
Таблица 8. Плотность водных растворов при 180С
| w, % | H2SO4 | K2Cr2O7 |
| 1,013 | 1,0122 | |
| 1,027 | 1,0264 | |
| 1,040 | 1,0408 | |
| 1,055 | 1,0554 | |
| 1,069 | 1,0703 | |
| 1,083 | – |
Таблица 9. Задания к определению влажности соли K2Cr2O7
| № задания | ||||||||
| Навеска соли, г | 3,9 | 6,8 | 8,7 | 4,6 | 2,4 | 7,2 | 6,4 | 7,9 |
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 795; Нарушение авторских прав?; Мы поможем в написании вашей работы!