
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химических реакций
|
|
|
|
Химическая кинетика изучает скорости и механизмы химических реакций [8]. Определение скорости: число элементарных актов химического взаимодействия частиц (в молях) за единицу времени в единице объема (в л) – для гомогенных процессов и на единице поверхности раздела реагирующих фаз – для гетерогенных.
На практике скорость химического процесса обычно характеризуют изменением концентрации вещества (в растворе или в газовой фазе) за единицу времени. Так, если в момент времени 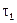 концентрация реагирующих соединений равна
концентрация реагирующих соединений равна 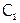 моль/л, а в последующий момент времени
моль/л, а в последующий момент времени  –
– 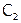 моль/л, то отношение:
моль/л, то отношение:
 ,
,
выражает среднюю скорость реакции (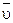 ) в интервале времени
) в интервале времени  . Чем меньше величина
. Чем меньше величина  , тем ближе отношение
, тем ближе отношение  к истинной скорости (
к истинной скорости (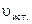 ) в соответствующий момент времени, т.е. можно записать:
) в соответствующий момент времени, т.е. можно записать:
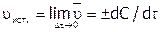 .
.
Для гомогенных процессов такая скорость (т.е. интенсивность реакции) пропорциональна теоретической (определение которой дано выше), но для гетерогенных – первая зависит от величины поверхности раздела фаз, а вторая – нет [8]. Зависимость же любой скорости от других факторов (природы реагирующих веществ, их концентрации, Т) отражается т.н. кинетическим уравнением.
Для гомогенной одностадийной реакции (например:  ) оно записывается в соответствии со стехиометрией данного процесса (как и выражение
) оно записывается в соответствии со стехиометрией данного процесса (как и выражение 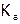 ), причем отдельно для скорости прямой реакции (
), причем отдельно для скорости прямой реакции (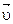 ) и обратной (
) и обратной (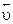 ). В частности, для нашего примера имеем:
). В частности, для нашего примера имеем:  и
и 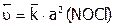 ,
,
где 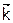 и
и  ‑ константы скоростей прямого и обратного процессов (они постоянны при данной Т). А степень, в которую возводится активность вещества в кинетическом уравнении, называется порядком реакции по данному веществу. Он показывает, в какой степени активность соответствующего соединения влияет на скорость.
‑ константы скоростей прямого и обратного процессов (они постоянны при данной Т). А степень, в которую возводится активность вещества в кинетическом уравнении, называется порядком реакции по данному веществу. Он показывает, в какой степени активность соответствующего соединения влияет на скорость.
|
|
|
Для гетерогенного или многостадийного процесса порядки, как правило, не совпадают по величине со стехиометрическими коэффициентами реакции и могут быть, в частности, дробными или равными нулю. К многостадийным процессам относится, например, разложение тиосульфата натрия при подкислении:

или в ионном виде: 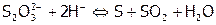 .
.
Подчеркнем, что кинетические уравнения, как и выражения 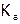 , записываются, только исходя из сокращенного ионного вида уравнения. Если бы данный процесс был одностадийным, то кинетическое уравнение для прямой реакции, выраженное через концентрации, имело бы вид:
, записываются, только исходя из сокращенного ионного вида уравнения. Если бы данный процесс был одностадийным, то кинетическое уравнение для прямой реакции, выраженное через концентрации, имело бы вид:
 .
.
В действительности это взаимодействие включает как минимум четыре стадии:
1)  , 2)
, 2)  ,
,
3)  , 4)
, 4) 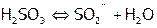 ,
,
а значит, приведенное выше кинетическое уравнение является формально - кинетическим [19]. Истинный порядок данной реакции по каждому из реагирующих веществ предлагается оценить экспериментально (опыт 1).
Подчеркнем, что скорость 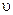 любого обратимого процесса равна разности значений
любого обратимого процесса равна разности значений 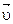 и
и 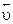 . Но разложение тиосульфата можно условно считать необратимым, т.к. есть продукты, которые выводятся из сферы реакции (S и SO2), поэтому значением
. Но разложение тиосульфата можно условно считать необратимым, т.к. есть продукты, которые выводятся из сферы реакции (S и SO2), поэтому значением 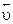 можно пренебречь и считать скорость равной
можно пренебречь и считать скорость равной 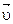 .
.
Кроме того, время окончания наблюдения в опытах 1 и 2 фиксируется по едва заметному появлению мути (начало образования продукта – серы), т.е. на начальной стадии процесса, когда скорость обратной реакции тем более можно не учитывать.
ЛАБОРАТОРНАЯ РАБОТА
«Скорость химических реакций»
1. Определение константы скорости и порядка реакции. Налить в четыре пробирки 5%-ный тиосульфат натрия и воду в следующих пропорциях:
| Номер пробирки | V р-ра (Na2S2O3), мл | V воды, мл |
| – |
В приготовленные растворы тиосульфата натрия добавить по 1 мл 2,5%‑ной серной кислоты и заметить по секундомеру, через какой промежуток времени после сливания появится едва заметная муть. Чем вызвано помутнение? Написать уравнение реакции. Результаты занести в таблицу:
|
|
|
| Номер опыта | ω(Na2S2O3), % | Время, с |
Аналогично описанному выяснить, как зависит скорость реакции от концентрации кислоты (опыты 5 – 8), изменяя ее объем от 1 до 4 мл, а объем воды – от 3 мл до 0 соответственно (лить кислоту в воду!). Объем 5%-го тиосульфата, добавляемый к приготовленным растворам кислот, брать равным 1 мл.
На основании полученных результатов определить порядки реакции по ионам:  и
и 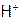 , и оценить значение константы скорости в кинетическом уравнении исследуемого процесса:
, и оценить значение константы скорости в кинетическом уравнении исследуемого процесса: 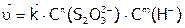 ,
,
считая, что  , где
, где 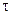 – время от начала реакции до момента появления мути (в секундах), а
– время от начала реакции до момента появления мути (в секундах), а  . (Поскольку k – это скорость реакции в стандартных условиях (в частности, при активностях реагентов равных 1 моль/л, то по аналогии с равенством:
. (Поскольку k – это скорость реакции в стандартных условиях (в частности, при активностях реагентов равных 1 моль/л, то по аналогии с равенством: 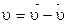 имеем:
имеем:  ), но если принять
), но если принять 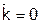 (случай кинетически необратимых реакций), то
(случай кинетически необратимых реакций), то  .)
.)
Найти n, m и k предлагается следующим способом. Поскольку в первой части эксперимента (опыты 1 – 4)  , то можно записать:
, то можно записать:
 , где
, где 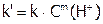 ,
,
или: 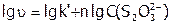 , т.е. получаем уравнение типа:
, т.е. получаем уравнение типа: 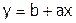 .
.
Рассчитать значения величин, необходимых для определения n, m и k, и представить в виде таблицы:
| Номер опыта | 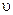 , с-1 , с-1
| 
| 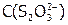
| 
| 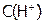
| 
|
| … | ||||||
Построив по данным эксперимента (опыты 1-4) график зависимости  от
от  , найти величину n (как tg угла наклона полученной прямой к оси
, найти величину n (как tg угла наклона полученной прямой к оси  ) и
) и 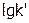 (отрезок, отсекаемый прямой на оси
(отрезок, отсекаемый прямой на оси  ). Обработав аналогично результаты опытов 5 – 8 (при
). Обработав аналогично результаты опытов 5 – 8 (при  ), определить значения m и k.
), определить значения m и k.
По рассчитанным двум значениям k найти среднее арифметическое ( ) и написать кинетическое уравнение процесса разложения тиосульфат-ионов, подставив найденные значения n, m и
) и написать кинетическое уравнение процесса разложения тиосульфат-ионов, подставив найденные значения n, m и  . Каков общий порядок данной реакции?
. Каков общий порядок данной реакции?
2. Определение температурного коэффициента реакции и оценка ее энергии активации. Налить в три сухие пробирки по 1 мл 2,5%-ной серной кислоты, а в три другие – по 1 мл 5%-го тиосульфата натрия. Первый опыт провести при комнатной температуре. Быстро прилить серную кислоту к тиосульфату натрия и отметить время (по секундомеру) до едва заметного помутнения раствора.
|
|
|
Затем провести аналогичный опыт, но при Т на 100С выше комнатной, для чего следующую пару пробирок перед смешиванием растворов нагревать в течение 15 минут на водяной бане, температуру которой контролировать термометром.
Далее, нагревая растворы таким же способом, провести опыт при Т, на 200С превышающей комнатную. Полученные данные записать в таблицу:
| Номер опыта | Температура, 0С | Время, с |
На основании экспериментальных данных рассчитать значение температурного коэффициента. Выполняется ли правило Вант-Гоффа в данном эксперименте?
Используя формулу Аррениуса в логарифмическом виде:  ,
,
оценить значение 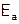 , построив график зависимости
, построив график зависимости  (принять k равным
(принять k равным 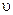 ) от величины
) от величины 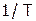 , где Т – температура раствора по Кельвину.
, где Т – температура раствора по Кельвину.
3. Влияние концентрации гомогенного катализатора на скорость реакции (на примере разложения H2O2 в присутствии дихромата калия)
Собрать установку (рис. 6). Заполнить бюретку (1) водой до верхнего деления, затем, закрыв большим пальцем отверстие бюретки, перевернуть ее и погрузить в ванну (2) с водой той же температуры (следить, чтобы во время опыта Т в ванне была постоянной). Закрепить бюретку в штативе и отметить уровень жидкости в ней.
 Отмерить цилиндром 30 мл 0,1%-го дихромата калия и вылить в колбу (3). В другую колбу налить 20-25 мл 10%-го H2O2, поставить ее в ванну (2) и выдержать 15 мин. Отобрать пипеткой 5 мл H2O2, вылить в колбу с дихроматом калия и сразу же закрыть пробкой с газоотводной трубкой (4), введенной в бюретку Непрерывно и равномерно встряхивая колбу (не вынимая ее из ванны), через каждые 30 с измерять объем выделившегося кислорода. При этом один студент, равномерно встряхивая колбу, снимает показания уровня воды в бюретке по сигналу «Внимание, отсчет!» второго студента, который следит за временем и записывает показания.
Отмерить цилиндром 30 мл 0,1%-го дихромата калия и вылить в колбу (3). В другую колбу налить 20-25 мл 10%-го H2O2, поставить ее в ванну (2) и выдержать 15 мин. Отобрать пипеткой 5 мл H2O2, вылить в колбу с дихроматом калия и сразу же закрыть пробкой с газоотводной трубкой (4), введенной в бюретку Непрерывно и равномерно встряхивая колбу (не вынимая ее из ванны), через каждые 30 с измерять объем выделившегося кислорода. При этом один студент, равномерно встряхивая колбу, снимает показания уровня воды в бюретке по сигналу «Внимание, отсчет!» второго студента, который следит за временем и записывает показания.
Отметить окраску раствора в начале процесса и когда он закончится. (Опыт длится 8-10 мин.)[20] Результаты занести в таблицу:
 w(K2Cr2O7),
Время
от начала
опыта, с w(K2Cr2O7),
Время
от начала
опыта, с
| % | 0,1 | 0,05 | |
| Объем выделившегося кислорода, мл | ||||
| … … … |
Провести аналогичный опыт, используя 0,05%-ный раствор дихромата калия, а затем без раствора дихромата калия, заменив его тем же объемом воды.
|
|
|
Сравнить результаты проведенных экспериментов, построив на одном графике кинетические зависимости для каждого опыта (откладывая на оси абсцисс время, а на оси ординат – объем кислорода, выделившегося за каждые 30 с). Как зависит скорость реакции от концентрации катализатора? Написать уравнения суммарной реакции и ее стадий, включая образование интермедиата.
(Если провести разложение пероксида водорода в присутствии катализатора диоксид марганца, то будет ли от его количества зависеть скорость реакции?)
4. Автокатализ. К 5 каплям 5%-ой щавелевой кислоты добавить 3 капли 1М H2SO4, затем 2 капли перманганата калия, отметить время, за которое произойдет обесцвечивание раствора и снова добавить 2 капли перманганата. Изменилось ли время обесцвечивания после 2-го добавления? А после 3-го? Какой продукт реакции является катализатором данного процесса?
5. Действие ингибитора. В 2 пробирки налить до 1/4 объема 1М 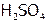 и по капле раствора
и по капле раствора 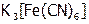 [21] (зачем?). В одну добавить микрошпатель уротропина. Две одинаковые железные проволоки очистить наждачной бумагой и опустить в пробирки. По времени появления достаточно интенсивной синей окраски оценить скорости реакций в пробирках и сделать вывод о роли уротропина.
[21] (зачем?). В одну добавить микрошпатель уротропина. Две одинаковые железные проволоки очистить наждачной бумагой и опустить в пробирки. По времени появления достаточно интенсивной синей окраски оценить скорости реакций в пробирках и сделать вывод о роли уротропина.
6. Влияние величины поверхности реагирующего вещества на интенсивность гетерогенной реакции. Уравновесить на технических весах два пустых стаканчика, затем – с мелом. (Причем в один поместить мел кусочками, а в другой – мелкораздробленный.) Затем в оба стаканчика одновременно добавить одинаковый объем (1 мл) 1М HCl. Сохраняется ли равновесие весов? В каком стаканчике быстрее закончится реакция? Влияет ли величина поверхности раздела фаз на скорость?
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1220; Нарушение авторских прав?; Мы поможем в написании вашей работы!