
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Автоклавний метод отримання порошків
|
|
|
|
Сутність автоклавного методу отримання порошків полягає в тому, що метал відновлюється з водних розчинів його солей газоподібним відновленням за підвищених температур і тиску.
Найбільш широкого застосування автоклавний метод набув для виробництва порошків міді, нікелю і кобальту. Як вихідну сировину можна застосовувати сульфати цих металів чи металоаміачні комплексні солі, які використовують у готовому вигляді, або отримують переробленням напівпродуктів металургійних переділів, що містять сульфіди чи металевого скрапу. Використовуючи сульфідовмісну сировину метал переводять у розчин обробкою сульфідів кисневмісними газами, найчастіше збагаченим киснем повітрям за наявності сірчаної кислоти. Процес проводять за температури 100…125 °С, парціального тиску кисню 0,2…0,5 МПа і витрати сірчаної кислоти одного моля на один моль металу протягом 6…8 год до кінцевої концентрації сірчаної кислоти 2…4 г/л. При цьому, наприклад, отримання сульфіду міді супроводжується перебігом реакції:
Cu2S + O2 + 2H2SO4=2CuSO4 + S + 2H2O. (5.11)
Якщо як вихідну сировину використовують скрап (стружку, брухт і т.ін.), то окиснювальну обробку металів проводять в розчинах, що містять аміак і сульфат чи карбонат амонію. Тоді утворюється складна металоаміачна комплексна сіль за реакцією:
Cu + 1/2O2 + 2NH3 + (NH4)2SO4 = [Cu(NH3)4]SO4 + H2O. (5.12)
Отриману сировину безпосередньо чи в стадії постачання використовують для відновлення з нього металів. Процес проводять в автоклавах за загального тиску газу 3…4 МПа. При цьому парціальний тиск газу-відновника становить 1…2 МПа. У разі використання як вихідної сировини сульфатів відновниками можуть бути водень, оксид вуглецю і сірчаний ангідрид:
|
|
|
MeSO4 + H2 = Me + H2SO4; (5.13)
MeSO4 + SO2 + 2H2O=Me + 2H2SO4;
MeSO4 + CO=Me + H2SO4 + CO2.
Для використання як газу відновника оксиду вуглецю одним з продуктів реакції є діоксид вуглецю, який змішується з газом-відновником й утруднює повну його участь в процесі відновлення. Застосування як вихідної сировини сульфатів приводить до того, що одним з продуктів відновлення стає сірчана кислота, утворення якої негативно впливає на рівновагу реакції. Крім того, сірчана кислота створює агресивне середовище, що потребує для виготовлення автоклавів і технологічного оснащення корозійностійких дорогих матеріалів. Останнє посилюється застосуванням як відновника сірчаного ангідриду, оскільки в цьому випадку, порівняно з використанням інших відновників, утворюється в два рази більше сірчаної кислоти, що різко погіршує умови відновлення, а також утруднює використання відпрацьованого розчину в замкненому технологічному циклі.
Більш прийнятні як вихідна сировина – аміачні комплексні солі. В промисловості використовують розчини як на основі (NH4)2CO3, так і на основі (NH4)2SO4.
Відновлюють метали з водних розчинів цих солей за наявності надлишку аміаку, що нейтралізує утворену сірчану кислоту. Як відновник зазвичай використовують водень, оскільки він має вищу відновлювальну здатність. Наприклад, для отримання міді із сірчанокислих розчинів швидкість відновлення зменшується в ряду H2®SO2®CO. У процесі відновлення комплексних солей воднем перебігає реакція, яка для випадку отримання порошків міді має вигляд:
[Cu(NH3)4]SO4+H2+2H2O = Cu+(NH4)2SO4+2NH4OH. (5.14)
Процес відновлення воднем проводять за його парціального тиску 1,0…3,0 МПа і температури 150…200 °С. Для використання аміачних комплексних солей потрібні вищі температури (180…200 °С), що зумовлено підвищеними енергетичними витратами на розкладання комплексних катіонів 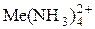 . Розкладання спричиняється витісненням металу воднем у розчині з його простого катіона за схемою
. Розкладання спричиняється витісненням металу воднем у розчині з його простого катіона за схемою
|
|
|
Men+ + H2 ® Me + 2H+.
Механізм витіснення металу в розчині воднем подібний до електролітичного виділення металу на катоді. Осадження металу з розчину його солі буде відбуватись, якщо потенціал виділення водню 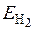 електронегативніший від потенціалу іонів металу відносно електрода з цього металу, тобто виконується нерівність
електронегативніший від потенціалу іонів металу відносно електрода з цього металу, тобто виконується нерівність
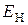 <
<  .
.
Потенціал іонів металу, як і у випадку електролізу, визначають за виразом
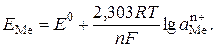 (5.15)
(5.15)
Потенціал водню можна визначати, виходячи з того, що він переходить розчин за реакцією іонізації:
0,5H2 ® H+ + e,
константа рівноваги для якої
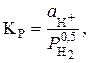
де  – активність (концентрація) іонів водню у розчині, моль/л;
– активність (концентрація) іонів водню у розчині, моль/л;
 – парціальний тиск водню.
– парціальний тиск водню.
Тоді
 (5.16)
(5.16)
Ураховуючи, що  вважають рівним нулю, n = 1, а
вважають рівним нулю, n = 1, а  , рівняння (5.16) можна записати у вигляді
, рівняння (5.16) можна записати у вигляді
 . (5.17)
. (5.17)
Прирівнюючи рівняння (5.17) до (5.15), можна знайти рівноважну концентрацію іонів металу в розчині, перевищення якої спричинить виділення металу:

На рівноважну концентрацію іонів металу буде впливати як рН розчину, так і парціальний тиск водню. Зміна рН розчину на одиницю впливає так само, як збільшення тиску водню в 100 разів. Залежності рівноважної активності іонів міді, кобальту і нікелю у розчинах з різними значенням рН за температури 25°С і тиску 0,1 МПа показано на рис. 5.15. Видно, що такий електропозитивний метал, як мідь, за атмосферного тиску може виділятись з розчину з доволі високою кислотністю. Водночас виділення кобальту і нікелю потребує низької кислотності. У зв’язку з цим отримання мідного порошку можливе як з сульфатних розчинів, коли реакція відновлення (5.9) перебігає з виділенням сірчаної кислоти, так і в разі використання комплексних аміачних солей з надлишком аміаку, коли утворена сірчана кислота нейтралізується (5.10) з утворенням сульфату амонію.

Рис. 5.15. Залежність рівноважної активності іонів металів від значень рН:
1 – Cu2+; 2 – Ni2+; 3 – Co2+
На практиці, для зсуву реакцій (5.11) і (5.12) вправо, тобто в бік відновлення, процес проводять за підвищених тисків водню і температури. При цьому швидкість відновлення воднем прямо пропорційна квадратному кореню з його парціального тиску, а швидкість відновлення СО і SО4 прямо пропорційна парціальному тиску відповідного газу. Якщо про швидкість відновлення судити за кількістю міді, що залишилась у розчині, то для отримання міді має використовуватись залежність, показана на рис. 5.16.
|
|
|
Швидкість осадження металу варто пов’язувати з процесами, що відбуваються під час відновлення, і впливом на них різноманітних чинників, перш за все складу розчину, природи газу-відновника, його парціального тиску, температури, наявності каталізатора та інших домішок.

Рис. 5.16. Вплив парціального тиску водню (МПа) на швидкість відновлення міді:
1 – 0,7; 2 – 1,4; 3 – 2,1; 4 – 2,8; 5 –3,5
Швидкість осадження металу варто пов’язувати з процесами, що відбуваються під час відновлення, і впливом на них різноманітних чинників, перш за все складу розчину, природи газу-відновника, його парціального тиску, температури, наявності каталізатора та інших домішок.
В основі автоклавного відновлення лежить гетерогенний процес, який складається з таких етапів:
1) розчинення газоподібного відновника в розчині на межі газ – рідина;
2) перенесення розчиненого газу від межі газ – рідина в об’єм розчину до реакційної поверхні;
3) адсорбція газу – відновника на реакційній поверхні з подальшим активуванням його молекул (для водню);
4) реакція між іонами металу і газу відновника з осадженням металу;
5) відведення розчинних продуктів реакції від реакційної поверхні в об’єм розчину і перенесення у зворотному напрямі іонів металу.
У зв’язку з цим вплив на швидкість процесу рН розчину і тиску газу варто пов’язувати з підвищенням концентрації іонів водню протягом часу та інтенсифікацією процесу розчинення газоподібного відновника зі збільшенням тиску газу.
Одна з лімітуючих стадій автоклавного відновлення – процес зародження нової фази, який може бути гомогенним чи гетерогенним. Гомогенний процес починається з повільного самочинного зародження нової фази, з появою якої процес значно прискорюється, тобто набуває автокаталітичного характеру. Самочинне утворення нової фази в об’ємі розчину дуже повільне й енергетично мале, імовірно, у зв’язку з великими значеннями енергії дисоціації молекул газу (для водню 425 кДж/моль).
|
|
|
Метал виникає не в об’ємі розчину, а на твердих поверхнях, що сорбують гази з розчину, найчастіше на стінках автоклава та інших металевих частинах апарата, що є небажаним явищем.
Для прискорення процесу зародкоутворення в розчин вводять каталізатори; як такі доцільніше використовувати дисперсні порошки металів, що аналогічні відновлюваному. У цьому разі процес стає гетерогенним. Частинки металу, що вводяться, слугують центрами кристалізації. Наприклад, у процесі отримання порошку міді з аміачних розчинів за температури 190 °С і тиску водню 2,2 МПа помітного виділення міді з розчину не спостерігається навіть після 100 хв
(рис. 5.17, крива 1). Уведення як каталізатора готового порошку приводить за цей же період до майже повного виділення міді з розчину. Зі збільшенням умісту порошку міді, що вводиться в розчин, швидкість процесу збільшується (рис. 5.17, криві 2, 3). Як каталізатор, а також домішка, що регулює розмір отримуваних частинок порошку, можна використовувати ПАР, наприклад, поліакриламід. Збільшення вмісту введеного каталізатора зумовлює зазвичай зменшення розміру отримуваних частинок порошку.
Механізми впливу на розмір отримуваних частинок порошку металічних порошків і ПАР різноманітні. Зменшення розміру частинок отримуваного порошку зі збільшенням кількості та дисперсності введеної порошкової домішки зумовлено перерозподілом виділеного металу між центрами кристалізації. З уведенням ПАР його молекули адсорбуються на поверхні частинок, блокуючи їх зростання. Як наслідок зменшується розмір отримуваних частинок порошку, спрощується їх форма, збільшується текучість і насипна щільність. Оптимальний вміст уведеного ПАР – 3…7 мг/г отримуваного металу. За вищого вмісту ПАР проявляється їх флокулювальна дія, що супроводжується утворенням конгломератів дрібних частинок і збільшенням середнього розміру отримуваного порошку. Крім того, стає помітним уміст вуглецю в отримуваному порошку, що неприпустимо, оскільки далі ускладнюється обробка порошку.
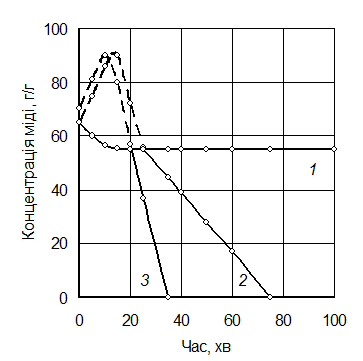
Рис. 5.17. Залежність концентрації міді в розчині від часу процесу за різних кількостей каталізатора (порошку міді):
1 – без каталізатора; 2 – 50 г/л; 3 – 100 г/л
Температура процесу, інтенсифікуючи, впливає на відновлення в автоклавах. Так, зі збільшенням температури на 10 °С швидкість процесу зростає приблизно в 1,5…2,0 рази. Однак надмірне підвищення температури спричиняє збільшення частинок за рахунок їх агломерації, розкладання і десорбції ПАР, що обмежують ріст частинок.
Залежно від вихідної сировини вибирають оптимальні температури. Так, для роботи із сульфатними розчинами температура процесу становить 150 °С, з аміачно-карбонатними – близько 170 °С, з аміачно-сульфатними – 195…205 °С.
Важливого значення для отримання порошків в автоклавах набуває інтенсифікація перемішування розчину. Останнє сприяє інтенсифікації дифузійного перенесення реагентів до реакційної поверхні і вилученню продуктів реакції, що істотно прискорює швидкість процесу в цілому. Інтенсивність перемішування залежить від кількості обертів мішалки і її конструкції. Однак для кожного конкретного випадку існує критична кількість обертів мішалки, за якої виникають кавітаційні явища. Зазвичай застосовують інтенсивність перемішування, що відповідає числу Re = 104. Поряд зі збільшенням швидкості процесу інтенсифікації перемішування сприяє утворенню дрібніших частинок порошку.
Загалом властивості отримуваних автоклавним методом порошків (розмір, форма і їх похідні) залежать від сукупності чинників, що впливають на процес відновлення. Так, форма частинок порошку головним чином залежить від складу розчину, з якого відбувається відновлення. У сірчанокислому середовищі отримуються порошки голкоподібної форми, а в аміачно-сульфатній – більш рівноважної, неправильної форми. Наявність у розчинах підвищеного вмісту компонентів, що збільшують їх в’язкість, наприклад (NH4)2SO4, сприяє зменшенню розміру частинок порошків, збільшенню ступеня їх дендритності, зниженню інтенсивності проходження дифузійних процесів.
Один з технологічних варіантів регулювання розміру частинок – проведення процесу за декілька циклів. У цьому випадку розмір частинок збільшується послідовним нарощуванням металу на кристали, що випали перші. Для цього, після закінчення одного циклу, автоклав вимикають, після відстоювання осаду зливають відпрацьований розчин і заливають свіжий. Змінюючи кількість циклів, можна отримувати порошки, розмір частинок яких від 50... 200 мкм. Однак цей метод регулювання розміру частинок порошків має істотний недолік: продукт містить підвищену кількість домішок, особливо сірки.
У промислових умовах порошки можна отримувати в горизонтальних автоклавах з вертикальними мішалками. Для проведення процесу із сульфатних розчинів для виготовлення автоклавів використовують кислотостійкі складнолеговані Ni-Cr-Mn-Cu сталі, а за використанням аміачних комплексних солей – неіржавійні сталі. Продуктивність таких автоклавів у десятки разів вища, ніж електролізних ванн такого ж об’єму.
Змінюючи режими отримання і склад розчинів, можна в широких межах варіювати властивості отримуваних порошків. Типові властивості автоклав них порошків міді наведено в табл. 5.8
Таблиця 5.8
Властивості автоклавних порошків міді
| Властивість | Значення |
| Вміст основного компонента, % | 99,5…99,95 |
| Середній розмір частин P, мкм | 2…45 |
| Питома поверхня S пит, м2/кг | 20…180 |
Насипна маса  , кг/м3 , кг/м3
| 0,9…2,9 |
| Текучість, г/с | 0…2,6 |
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 691; Нарушение авторских прав?; Мы поможем в написании вашей работы!