
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поверхностное натяжение. Особые свойства поверхности раздела фаз
|
|
|
|
Особые свойства поверхности раздела фаз.
Классификация дисперсных систем
а. По агрегатному состоянию дисперсионной среды системы могут быть газовыми, жидкими и твердыми (всего 8 видов)

 Г – газовые смеси являются гомогенными
Г – газовые смеси являются гомогенными

 Ж – туман, аэрозоль, облака
Ж – туман, аэрозоль, облака
Т – дым, смог, порошки.

 Г - пены
Г - пены

 Ж – эмульсии
Ж – эмульсии
Т – золи, суспензии, взвеси

 Г – пемзы, пенопласт
Г – пемзы, пенопласт

 Ж –минералы
Ж –минералы
Т – сплавы, сталь, чугун.
б. По размеру частиц дисперсно й фазы (по степени дисперсности)
| <10-9м | 10-9-10-7м | 10-7-10-5м | >10-5м |
| Истинные растворы. | Ультрамикро- гетерогенные системы (коллоидные) | Микрогетеро- генные системы | Грубодисперсные системы. |
в. По форме частиц дисперсной фазы:
· одномерные (пленки, мембраны);
· двумерные (нити, волокна, капилляры);
· трехмерные (твердые частицы, капли, пузырьки, поры)
Если хотя бы одно измерение имеет коллоидные размеры, такая система является объектом изучения коллоидной химии
г. По характеру взаимодействия дисперсной фазы с дисперсионной средой:
– лиофобные («не любят» среду)
– лиофильные («любят» среду)
Чем больше раздроблена дисперсная фаза, то есть чем больше дисперсность и мельче частицы, тем больше площадь поверхности раздела фаз. Так, кубик с ребром 1 см имеет суммарную площадь поверхности 6 см2. При дроблении его на кубики с ребром 1 мм. площадь поверхности увеличивается в 10 раз и т.д.


Рис 1.1. Увеличение площади поверхности при дроблении
В человеческом организме суммарная площадь поверхности кожи 1,5 м2, альвеол легких 1000м2, эритроцитов 3000 м2.
На любой поверхности раздела фаз поверхностные молекулы обладают более высоким запасом энергии, чем глубинные молекулы. Рассмотрим двухфазную систему, например «Г-Ж».
|
|
|
 – для глубинной молекулы жидкости силы межмолекулярного взаимодействия ее с такими же окружающими ее молекулами жидкости одинаковы и их равнодействующая равна нулю (Рис. 1.2).
– для глубинной молекулы жидкости силы межмолекулярного взаимодействия ее с такими же окружающими ее молекулами жидкости одинаковы и их равнодействующая равна нулю (Рис. 1.2).
|
– для поверхностной молекулы силы межмолекулярного взаимодействия с такими же молекулами своей фазы выше, чем с газовыми молекулами контактирующей фазы. Поэтому равнодействующая этих сил направлена в глубь жидкой фазы. Так возникает поверхностное натяжение. Преодолевая силы межмолекулярного взаимодействия и оставаясь на поверхности, поверхностные молекулы имеют повышенную (избыточную) энергию, чем глубинные.
Избыточной поверхностной энергией называется суммарная энергия всех молекул поверхности раздела фаз. Это – свободная энергия Гиббса, если Р = const, Т = const.
G = σ ∙ S (1.1)
S – суммарная площадь поверхности (м2)
σ - поверхностное натяжение, Дж/м2
Выразим σ из уравнения (1.1)
σ = 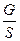 ;
; 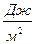 (1.2)
(1.2)
Из уравнения 1.2. видно, что поверхностное натяжение – это удельная поверхностная энергия, т.е. избыточная энергия, приходящаяся на единицу площади поверхности. С другой стороны, поверхностное натяжение можно рассматривать как энергию, которую нужно затратить на создание единицы площади поверхности. Поверхностное натяжение чистых веществ при постоянной температуре – это постоянная величина. Поверхностное натяжение зависит от многих факторов:
1.природы контактирующих фаз. Чем больше разность их полярностей, тем выше поверхностное натяжение. Например, для H2О (полярная жидкость) σ = 72∙10-3 Дж/м2, а для бензола, C6H6 (неполярная жидкость) σ = 29∙10-3 Дж/м2.
2. температуры; с ее повышением σ уменьшается до нуля при критической температуре.
3. способности к образованию водородных связей.
|
|
|
4. агрегатного состояния; у твердых веществ σ всегда значительно выше, чем у жидкостей.
5. присутствия других веществ.
Поверхностное натяжение – это одна из основных характеристик дисперсных систем.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1193; Нарушение авторских прав?; Мы поможем в написании вашей работы!