
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная электрическая проводимость растворов электролитов
|
|
|
|
Электрическая проводимость растворов электролитов. Кондуктометрия
Электрическая проводимость (электропроводность) – это способность вещества проводить электрический ток.
Она является величиной обратной электрическому сопротивлению. По способности вещества проводить ток все проводники разделяют на два типа:
Проводники первого рода – металлы, в них электропроводность обусловлена направленным движением свободных электронов.
Проводники второго рода – это растворы электролитов. В них электропроводность возникает при наложении внешнего поля за счет направленного движения катионов к отрицательно заряженному электроду, катоду, а анионов к положительному электроду, аноду. В отсутствии внешнего поля ионы движутся хаотично и тока нет.
Способность раствора электролита проводить ток определяется главным образом
- количеством ионов
- подвижностью ионов.
Подвижность ионов, т.е. скорость их направленного движения к электродам, способность преодолевать сопротивление среды, зависит от:
1. природы растворителя. Чем выше его полярность и вязкость, тем меньше в нем подвижность ионов. Полярные растворители сильнее сольватируют ионы, делая их крупнее и менее подвижными.
2. природы иона. Чем меньше радиус иона и больше его заряд, тем больше ион сольватирован и менее подвижен. Поэтому подвижность гидратированных ионов 1 группы возрастает от Li к Cs.
Самой высокой подвижностью обладают протоны и гидроксид-ионы (Н+ и ОН–) в водных растворах. Но это объясняют особым «эстафетным» механизмом их перемещения.
3. температуры. С повышением температуры уменьшается вязкость среды и толщина сольватных оболочек, а значит возрастает подвижность ионов.
|
|
|
4. ионной силы. Чем сильнее межионное взаимодействие, тем сильнее тормозящий эффект.
5. концентрации ионов. Чем она выше, тем выше электростатическое взаимодействие ионов, снижающее их подвижность.
Концентрация ионов зависит и от силы электролитов. В растворах слабых электролитов (α < 0,03) концентрация ионов всегда невелика. При бесконечном разбавлении скорости движения ионов возрастают и достигают предельного значения. Их называют предельной электрической подвижностью ионов в данном растворителе и температуре.
Электрическая проводимость (электропроводность) обратна сопротивлению: L = 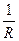 ;
; 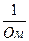 = См (6.1)
= См (6.1)
Единицей измерения в системе СИ является обратный Ом (Ом–1) или сименс, См.
Известно, что сопротивление любого проводника пропорционально его длине и обратно пропорционально сечению, S:
R = ρ • 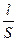 (6.2)
(6.2)
где ρ – удельное сопротивление, Ом•м, характеризующее природу проводника.
Подставляя уравнение (6.2) в уравнение в уравнение (6.1), получаем:
L = 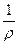 •
• 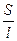 = æ •
= æ • 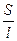
 (6.3)
(6.3)
где æ (каппа) – удельная электрическая проводимость, См/м, величина обратная удельному сопротивлению. Она характеризует свойства проводящей среды – раствора электролита.
Удельная электрическая проводимость представляет собой проводимость 1м3 раствора помещенного между параллельными электродами площадью 1м2, находящимися на расстоянии 1м.
В системе СИ единица измерения удельной электрической проводимости: См/м. В аналитической практике æ часто выражается в См/см.
1См/см = 102 См/м.
Удельная электропроводность максимальна у растворов сильных кислот и оснований из-за их полной диссоциации и высокой подвижности ионов Н+ и ОН–. Наименьшей удельной электропроводностью обладают растворы слабых электролитов из-за низкой концентрации ионов. Удельная электропроводность зависит от концентрации электролита. С повышением концентрации она проходит через максимум, а затем уменьшается. Это связано, для сильных электролитов, с возрастанием мешающего межионного взаимодействия, а для слабых – со снижением степени диссоциации.
|
|
|
Молярная (эквивалентная) электрическая проводимость растворов электролитов.
Молярная электрическая проводимость раствора электролита (λ, лямбда) равна удельной электрической проводимости его раствора с концентрацией 1 моль/м3.
λ = 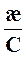 (6.4)
(6.4)
где æ – удельная электропроводность, См/м,
С – концентрация раствора электролита, моль/м3.
В системе СИ λ выражается в См • м2/моль.
λ = 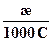 , См∙м2/моль (6.5)
, См∙м2/моль (6.5)
Поскольку в аналитической практике молярная концентрация выражается в моль/л (1моль/л = 103моль/м3), то для расчетов чаще используют формулу (6.6)
λ = 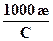 См∙см2/моль (6.6)
См∙см2/моль (6.6)
Влияние концентрации на молярную проводимость электролитов лучше проследить на графике зависимости λ от разбавления (1/С):
|
|
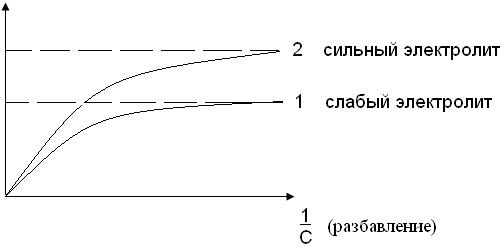
Рис.6.1. Зависимость молярной электрической проводимости от
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 3460; Нарушение авторских прав?; Мы поможем в написании вашей работы!