
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выберите один правильный ответ
|
|
|
|
Типовые задачи
Задача 1.Рассчитайте объем (см3) раствора серной кислоты с массовой долей 26 % (плотность раствора 1,19 г/см3), необходимого для приготовления 150 см3 раствора серной кислоты с молярной концентрацией 0,2 моль/дм3.
| Дано: | Решение: |
| W(H2SO4) = 26 % | 1. Определить молярную массу серной кислоты: М(H2SO4) = 98 г/моль |
| ρ р(H2SO4) = 1,19 г/см3 | |
| V1(р-ра) = 150 см3 = 0,15 дм3 | 2. Найти массу вещества серной кислоты в 0,15 дм3 раствора с молярной концентрацией 0,2 моль/дм3: |
| С(H2SO4) = 0,2 моль/дм3 | |
| V2(р-ра) =? | m(H2SO4) = C(H2SO4) · M(H2SO4) · V1 = = 0,2 · 98 · 0,15 = 2,94 (г) |
| 3. Найти массу раствора серной кислоты с W (H2SO4) = 26 % m(H2SO4) 2,94 mр = ---------------- · 100 = --------- · 100 = 11,3 (г) W(H2SO4) 26 | |
| 4. Найти требуемый объем (см3) раствора серной кислоты: mр 11,3 V2 = ------- = --------- = 9,5 (см3) ρр 1,19 | |
| Ответ: V(H2SO4) = 9,5 см3 |
Задача 2. Раствор калия перманганата применяется в медицине как дезинфицирующее средство. Рассчитайте титр раствора KMnO4, содержащего 0,02 моль калия перманганата в 250 см3 раствора.
| Дано: | Решение: |
| n(KMnO4) = 0,02 моль | 1. Определить молярную массу калий перманганата: |
| Vр = 250 см3 | М(KMnO4) = 158 г/моль |
| t(KMnO4) =? | 2. Найти массу вещества калий перманганата: |
| m(KMnO4) = n(KMnO4) · М(KMnO4) = 0,02 · 158 = 3,16 (г) | |
| 3. Определить титр раствора калий перманганата: m(KMnO4) 3,16 t(KMnO4) = ------------------ = -------- = 0,01264 (г/см3) Vр 250 | |
| Ответ: t(KMnO4) = 0,01264 г/см3 |
Задача 3. Раствор натрия сульфата применяют в медицине перрорально как слабительное средство. Сколько граммов натрий сульфата необходимо для приготовления 200 см3 раствора с молярной концентрацией эквивалента С(½ Na2SO4) = 0,5 моль/дм3?
| Дано: | Решение: |
| С(½ Na2SO4) = 0,5 моль/дм3 | 1. Определить молярную массу эквивалента Na2SO4 |
| V р = 200 см3 = 0,2 дм3 | M (½ Na2SO4) = М(Na2SO4): 2 = 142: 2 = 71 г/моль |
| m(Na2SO4) =? | 2. Найти искомую массу натрия сульфата: |
| m(½ Na2SO4) = C(½ Na2SO4) · M(½ Na2SO4) · Vр = = 0,5 · 71 · 0,2 = 7,1 (г) | |
| Ответ: m(Na2SO4) = 7,1 г |
|
|
|
Задача 4. Определите титр раствора натрия гидроксида, если на тирование 5 см3 его раствора израсходовано 5,4 см3 раствора Н2SO4, с молярной концентрацией эквивалента С(½ Н2SO4) = 0,5 моль/дм3.
| Дано: | Решение: |
| V(NaOH) = 5 cм3 | 1. Определить молярную концентрацию эквивалента раствора натрий гидроксида, используя закон эквивалентов: С(NaOH) · V(NaOH) = C(½ Н2SO4) · V(½ Н2SO4) |
| V(Н2SO4) = 5,4 см3 | |
| С(½ Н2SO4) = 0,5 моль/дм3 | C(½ Н2SO4) · V(½ Н2SO4) 0,5 · 5,4 моль С(NaOH) = ---------------------------------- = ---------- = 0,54 ------ V(NaOH) 5 дм3 |
| t(NaOH) =? | |
| 2. Определить титр раствора натрий гидроксида: C(NaOH) · M(NaOH) 0,54 · 40 t(NaOH) = -------------------------------- = ------------- = 0,0216 (г/см3) 1000 1000 | |
| Ответ: t(NaOH) = 0,0216 г/см3 |
Тестовые задания для самоконтроля
01. ВЫБЕРИТЕ ПРАВИЛЬНОЕ ПОЛОЖЕНИЕ ГЛАЗ ПРИ ОПРЕДЕЛЕНИИ ОБЪЕМА РАСТВОРА В БЮРЕТКЕ



1) 2)  3)
3) 
02. РАСЧЕТЫ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЙ В ТИТРИМЕТРИИ ОСНОВАНЫ НА ЗАКОНЕ …
1) кратных отношений
2) действующих масс
3) Авогадро
4) эквивалентов
03.ВЕЛИЧИНА рН В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ БОЛЬШЕ 7 ПРИ ТИТРОВАНИИ:
1) сильной кислоты сильным основанием
2) слабой кислоты сильным основанием
3) сильного основания сильной кислотой
4) слабого основания сильной кислотой
04. ОБЪЕМ (МЛ) ДЕЦИМОЛЯРНОГО РАСТВОРА NаOH, НЕОБХОДИМЫЙ ДЛЯ ДОСТИЖЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ ПРИ ТИТРОВАНИИ 8,0 МЛ РАСТВОРА H2SO4С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ ЭКВИВАЛЕНТА 0,1 МОЛЬ·ДМ-3 РАВЕН:
1) 4,0 мл
2) 16,0 мл
3) 8,0 мл
4) 0,8 мл
05. КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ -
1) слабые неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
2) слабые органические кислоты или основания, окраска которых изменяется при изменении рН среды
3) сильные органические кислоты или основания, окраска которых изменяется при изменении рН среды
|
|
|
4) сильные неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
06.ПРИ ТИТРОВАНИИ РАСТВОРА ЩАВЕЛЕВОЙ КИСЛОТЫ (Н2С2О4) ИЗРАСХОДОВАНО 20 МЛ РАСТВОРА NAOH С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ·ДМ-3. МАССА КИСЛОТЫ (МГ) В РАСТВОРЕ РАВНА:
1) 135
2) 270
3) 45
4) 90
07. ЕСЛИ В МЕТОДЕ НЕЙТРАЛИЗАЦИИ В КАЧЕСТВЕ ТИТРАНТА ИСПОЛЬЗУЮТ ЩЕЛОЧЬ, ТО ТАКОЕ ОПРЕДЕЛЕНИЕ ОТНОСИТСЯ К:
1) ацидиметрии
2) алкалиметрии
3) окислительно-восстановительному титрованию
4) комплексонометрии
08. ВЕЩЕСТВА, КОТОРЫЕ ИСПОЛЬЗУЮТ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ ДЛЯ ФИКСИРОВАНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ, НАЗЫВАЮТСЯ:
1) эталонами
2) индикаторами
3) катализаторами
4) ингибиторами
09. ПРИ ТИТРОВАНИИ 20 МЛ РАСТВОРА УКСУСНОЙ КИСЛОТЫ ЗАТРАЧЕНО 16 МЛ РАСТВОРА КОН С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ 0,15 МОЛЬ·ДМ-3. МАССА СН3СООН В 200 МЛ ЭТОГО РАСТВОРА РАВНА:
1) 1,44 г
2) 5,6 г
3) 7,2 г
4) 4,32 г
10. НА ТИТРОВАНИЕ V(NA2B4O7. 10H2O) МЛ РАСТВОРА ТЕТРАБОРАТА НАТРИЯ С КОНЦЕНТРАЦИЕЙ С(½NA2B4O7. 10H2O) ИЗРАСХОДОВАНО V(HCl) МЛ РАСТВОРА HCl. ТИТР СТАНДАРТНОГО РАСТВОРА HCl T(HCl) РАССЧИТЫВАЮТ ПО ФОРМУЛЕ:
| 1) | 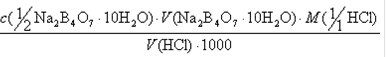
|
| 2) | 
|
| 3) | 
|
| 4) | 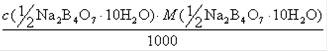
|
Контрольные задания
11. Определить молярную концентрацию натрия гидроксида в растворе, если массовая доля его в растворе составляет 26%. (r = 1,3 г/см3).
12. Рассчитать массовую долю (%) серной кислоты в растворе (r = 1,12 г/см3) с молярной концентрацией эквивалента серной кислоты С(½Н2SO4) = 0,5 моль/дм3.
13. При ожогах щелочами пораженный участок кожи в течение 5-10 минут промывают водой, а затем нейтрализуют раствором уксусной кислоты с массовой долей 1%. Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 1%-ного раствора массой 600 г?
14. В медицине применяется 5%-ный спиртовой раствор йода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10 г кристаллического йода? Плотность раствора 0,950 г/мл.
15. При укусах муравьев, при соприкосновении с крапивой на коже возникает чувство жжения за счет действия муравьиной кислоты. Какая масса муравьиной кислоты может быть нейтрализована с помощью 10 мл 2%-ного раствора NaHCO3, плотность которого равна 1,013 г/мл?
|
|
|
Литература
1. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2008. – С.65-87.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 2076; Нарушение авторских прав?; Мы поможем в написании вашей работы!