
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Произведение растворимости йодида свинца (II) при 20°С равно 8·10‾9
Пример.
Произведение растворимости йодида свинца (II) при 20°С равно 8·10‾9. Вычислите растворимость соли (в моль/л) при указанной температуре.
| t=20°С ПР(PbI2)= 8·10‾9 | Решение. Уравнение электролитической диссоциации растворенной соли (сильного электролита): PbI2 = Pb2+ + 2I‾. Уравнение гетерогенного равновесия в растворе: PbI2 (тв)↓ D Pb2+(р) + 2I‾(р). Обозначим искомую растворимость PbI2 через s (моль/л): s = С (PbI2). |
| S-? |
Концентрация растворившейся соли PbI2 в насыщенном растворе составляет s; за счет диссоциации данного сильного электролита в соответствии со стехиометрическими соотношениями в растворе содержится s моль/л ионов Pb2+ и 2s моль/л ионов I‾, т.е. [Pb2+] = s; [I‾] = 2s.
Согласно правилу произведения растворимости и с учетом приведенных соотношений:
 ,
,
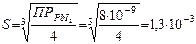 моль/л.
моль/л.
Ответ:S = 1,3*10-3 моль/л.
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. Гидролиз – частный случай сольволиза – реакции обмена между растворителем и растворенным веществом, разновидность реакций ионного обмена. В результате протекания гидролиза:
- происходит изменение pH среды;
- образуются малодиссоциирующие соединения.
Механизм гидролиза. Для разных типов соединений он различен. Так, гидролиз солей можно рассматривать:
во-первых, как процесс, обратный реакциям нейтрализации; реакция нейтрализации между различными по силе кислотами и основаниями не всегда протекает до конца вследствие протекания обратного процесса – гидролиза образующейся соли, например:
НСN + КОН D КСN + НОН;
во-вторых, как результат поляризационного взаимодействия ионов соли с их гидратной оболочкой (все ионы в растворе гидратированы); чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз.
Рассмотрим возможные случаи поляризующего действия ионов на гидратную оболочку:
|
|
Дата добавления: 2014-11-20; Просмотров: 1279; Нарушение авторских прав?; Мы поможем в написании вашей работы!