
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. · Рассчитать стандартное изменение энтальпии реакции:
· Рассчитать стандартное изменение энтальпии реакции:
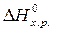 = å (n
= å (n 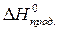 ) – å (m
) – å (m 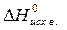 )= 2
)= 2 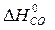 – (
– (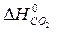 +
+ 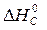 )=
)=
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
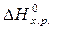 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Рассчитать стандартное изменение энтропии реакции:
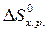 = å (n
= å (n 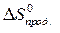 ) – å (m
) – å (m 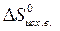 )=
)= 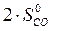 – (
– (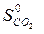 +
+ 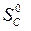 ) =
) =
=2·197,5 – (213,7 + 5,7) = 175,6 Дж/К = 175,6×10-3 кДж/К.
· Рассчитать стандартное изменение энергии Гиббса реакции:
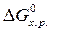 =
= 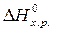 –
–  = 172,5 –298×175,6×10-3 = 120,2 кДж.
= 172,5 –298×175,6×10-3 = 120,2 кДж.
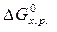 > 0, при Т = 298 К прямая реакция невозможна.
> 0, при Т = 298 К прямая реакция невозможна.
· Определить температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями  и D S от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: D G = D Н – Т× D S »
и D S от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: D G = D Н – Т× D S » 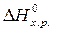 –
– 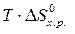
 =
= 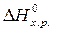 –
– 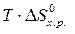 = 0 Þ Т =
= 0 Þ Т =  =
= 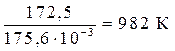
· Построить график зависимости 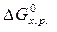 от Т.
от Т.
 |
Из графика видно, что в интервале температур 0 – 982 К D G > 0, следовательно, прямая реакция невозможна; выше 982 К D G < 0, т.е. самопроизвольно протекает прямая реакция.
Задания к подразделу 2.1
Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в соответствующей реакции (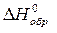 ,
, 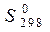 в табл. П.1). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении (из расчетных либо графических данных).
в табл. П.1). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении (из расчетных либо графических данных).
| Номер задания | Уравнение реакции |
| 2Mg(к) + CO2 (г) = 2MgO(к) + C (графит) | |
| 3CH4(г) + CO2(г) + 2H2O(ж) = 4CO(г) + 8H2(г) | |
| 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) | |
| 2Н2 S (г) + SO2(г) = 3S (ромб) + 2H2O(ж) | |
| 2Сu2О(т) + Сu2S (т) = 6Сu (к) + SO2(г) | |
| 2H2O (г) + 2Cl2 (г) = 4HCl (г) + O2 (г) | |
| 3Fe2O3(т) + Н2(г) = Н2O(г) + 2Fe3O4(т) | |
| CaO (т ) + CO2 (г) = CaCO3 (т) | |
| С (гр.) + СO2(г) = 2СО(г) | |
| 2ZnS(т) + 3О2(г) = 2ZnO(т) + 2SO2(г) | |
| СаСО3(т) = СаО(т) + СО2(г) | |
| ВaO(т ) + CO2 (г) = ВaCO3 (т) | |
| 2NO (г) + O2 (г) = 2NO2 (г) | |
| N2O4 (г) = 2NO2 (г) | |
| Al2O3 (т) + 3SO3 (г) = Al2(SO4) 3 (т) | |
| CaO (т ) + Н2O (ж) = Ca(ОН)2 (т) | |
| FeO(т)+ H2(г) = Fe(т) +Н2О(г) | |
| CuO(т) + C(т) = Cu(к) + CO(г) | |
| CaO (т ) +Fе2O3(т) = Ca(FеO2)2(т) | |
| CaO (т ) + SO3 (г) = CaSO4 (т) |
|
|
Дата добавления: 2014-12-08; Просмотров: 461; Нарушение авторских прав?; Мы поможем в написании вашей работы!